
| A. | Al3+ | B. | Ba2+ | C. | Cl- | D. | Mg2+ |
分析 n(NO3-):n(SO42-):n(Fe3+):n(H+):n(X)=2:3:1:3:1,根据根据电荷守恒,可以确定X为阳离子,然后利用离子不能反应生成水、气体、沉淀、不能发生氧化还原反应等确定X,以此来解答.
解答 解:物质的量之比为n(NO3-):n(SO42-):n(Fe3+):n(H+):n(X)=2:3:1:3:1,
溶液不显电性,而负电荷=2×1+3×2>正电荷=1×3+3×1,
则X为阳离子,由电荷守恒可知:2×1+3×2=×3+3×1+X,解得X=2,说明X为+2价阳离子,
由于SO42-与Ba2+反应生成硫酸钡沉淀,
所以X一定为Mg2+,
故选D.
点评 本题考查电荷守恒及离子的共存,题目难度不大,根据阳离子的电荷总数等于阴离子电荷总数确定M为阳离子是解答本题的关键,注意掌握离子反应发生条件,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:实验题
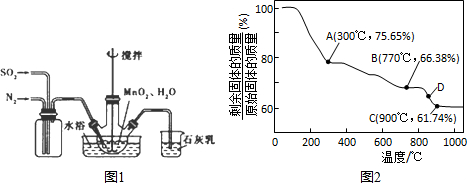
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向稀硫酸中滴加NaOH:2H++2OH-═2H2O | |
| B. | 向A1C13溶液中加入氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| C. | 向BaCl2溶液通入CO2:Ba2++CO2+H2O═BaCO3↓+2 H+ | |
| D. | 硫酸与氢氧化钡溶液反应:H++OH-+LV+Ba2++SO42-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸盐与盐酸之间的反应 | B. | 一切碳酸盐与一切酸之间的反应 | ||
| C. | 可溶性碳酸盐与强酸之间的反应 | D. | 可溶性碳酸盐与一切酸之间的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该硫酸的浓度为9.2 mol•L-1 | |
| B. | 配制480 mL 4.6 mol•L-1的稀硫酸需该H2SO4 125mL | |
| C. | 该硫酸与等体积水混合质量分数变为49% | |
| D. | 取该硫酸100 mL,则浓度变为原来的$\frac{1}{5}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达到化学平衡时,5v正(O2)=4v逆(NO) | |
| B. | 若单位时间内生成x mol NO,同时消耗x mol NH3,则可确定反应达到平衡状态 | |
| C. | 达到化学平衡时,若增大容器的体积,则正反应速率减小,逆反应速率也减小 | |
| D. | 化学反应速率的关系是2v正(NH3)=3v正(H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肯定不含I- | B. | 可能含有Cu2+ | C. | 一定含有SO32- | D. | 肯定不含有NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
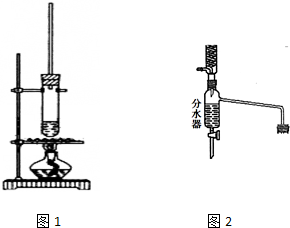 乙酸正丁酯常用作香精,实验室用冰醋酸和正丁醇制备乙酸正丁酯
乙酸正丁酯常用作香精,实验室用冰醋酸和正丁醇制备乙酸正丁酯| 物质 | 密度/g•cm-3 | 沸点/℃ | 溶解度/100g水 |
| 正丁醇 | 0.810 | 118.0 | 9 |
| 冰醋酸 | 1.049 | 118.1 | 互溶 |
| 乙酸正丁酯 | 0.882 | 126.1 | 0.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
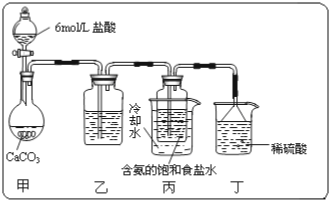
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com