
| A. | 福尔马林(甲酸):加入足量饱和碳酸钠溶液充分振荡,蒸馏,收集馏出物 | |
| B. | 溴苯(溴):加入NaOH溶液,充分振荡静置后,分液 | |
| C. | 乙醇(水):加入新制生石灰,蒸馏 | |
| D. | 乙酸(乙醇):加入金属钠,蒸馏 |
分析 A.HCHO与碳酸钠不反应,HCOOH与碳酸钠发生反应生成甲酸钠;
B.溴苯与NaOH不反应,溴单质与NaOH溶液反应生成盐溶液;
C.新制生石灰与水反应生成氢氧化钙;
D.乙酸和乙醇与金属钠都反应.
解答 解:A.HCHO与碳酸钠不反应,HCOOH与碳酸钠发生反应生成甲酸钠,增大与HCHO的沸点差异,则加入足量饱和碳酸钠溶液充分振荡,蒸馏,收集馏出物(HCHO),故A正确;
B.溴苯与NaOH不反应,溴单质与NaOH溶液反应生成盐溶液,而溴苯不溶于水,所以加入NaOH溶液充分振荡静置后分液,故B正确;
C.新制生石灰与水反应生成氢氧化钙,蒸馏时,可得到较为纯净的乙醇,故C正确;
D.乙酸和乙醇与金属钠都反应,不能用加金属钠的方法分离,故D错误.
故选D.
点评 本题考查物质的分离、提纯和除杂,难度不大,注意除杂是不能引入新的杂质、不能影响被提纯的物质的性质和量,并且操作简单可行,除杂时要结合物质的物理性质和化学性质进行分离.


科目:高中化学 来源: 题型:选择题
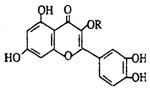
| A. | 可溶于有机溶剂 | B. | 分子中有三个苯环 | ||
| C. | 1mol维生素P可以和6molBr2反应 | D. | 1mol维生素P可以和4molNaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
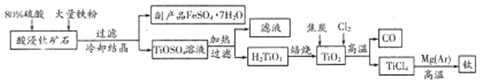
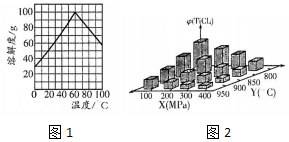
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
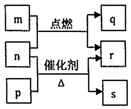 短周期元素W、X、Y、Z的原子序数依次增大.m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r为液体,其余均为无色气体,m的摩尔质量为p的2倍,n是元素Y的单质,是绿色植物光合作用产生的无色气体,p能使湿润的红色石蕊试纸变蓝,q能使品红溶液褪色.上述物质之间的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增大.m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r为液体,其余均为无色气体,m的摩尔质量为p的2倍,n是元素Y的单质,是绿色植物光合作用产生的无色气体,p能使湿润的红色石蕊试纸变蓝,q能使品红溶液褪色.上述物质之间的转化关系如图所示.下列说法正确的是( )| A. | 原子半径:X<Y<Z | |
| B. | 非金属性:X>Y>Z | |
| C. | W、X、Y、Z四种元素可形成离子化合物 | |
| D. | q与s均为酸性氧化物,m的水溶液显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 木材纤维和土豆淀粉遇碘水均显蓝色 | |
| B. | 食用油反复加热会产生稠环芳烃等有害物质 | |
| C. | 误食铜、铅或汞等重金属盐中毒后应立即服用大量的牛奶 | |
| D. | 食用花生油和鸡蛋清都能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
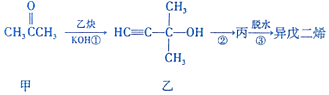
| A. | 甲分子中只有1种化学环境的氢原子 | |
| B. | 乙能发生加成反应、取代反应、消去反应 | |
| C. | 丙分子中的官能团有碳碳双键和羟基 | |
| D. | 上述每步转化属于消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 35L | B. | 30L | C. | 25L | D. | 20 L |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数116 | B. | 中子数177 | ||
| C. | 电子数116 | D. | 该原子可表示为:${\;}_{116}^{177}$Lv |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com