
【题目】碳酸氢钠是一种重要的化工原料,在日常生活中也有广泛的用途,侯德榜先生发明了连续生产纯碱与氯化铵的联合制碱工艺,成为近代化学工业的奠基人之一,该反应原理为:NH3+CO2+H2O+NaCl(饱和)=NaHCO3↓+NH4Cl △H<0。
现用如图所示装置和上述原理制取碳酸氢钠晶体,图中夹持装置已略去。
可选用的药品有:①石灰石②生石灰③6mol/L盐酸④稀硫酸⑤浓氨水⑥饱和氯化钠溶液⑦饱和碳酸氢钠溶液
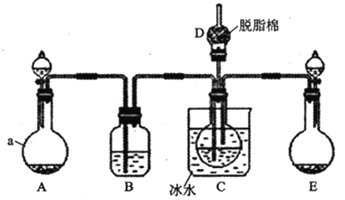
请回答下列问题:
(1)仪器a的名称是___。
(2)B中应选用的药品是___(填序号)
(3)在实验过程中,应先向C中通入的气体的化学式是___,其原因是___。
(4)D中脱脂棉应浸润的试剂是___(填写字母编号)。
a.浓硫酸 b.稀硫酸 c.氢氧化钠溶液 d.浓硝酸
(5)该小组同学为了测定C中所得晶体中碳酸氢钠的纯度(假设晶体中不含碳酸盐杂质),先将晶体充分干燥后,称量质量为wg,然后进行如图所示实验:

①操作Ⅲ中的方法是___,___,___。
②所得晶体中碳酸氢钠的纯度是___(不必化简)。
【答案】圆底烧瓶 ⑦ NH3 CO2在水中溶解度小,先通NH3至饱和,有利于NaHCO3析出 b 过滤 洗涤 干燥 ![]() ×100%
×100%
【解析】
(1)根据装置图判断仪器a的名称;
(2)B装置的作用为除去二氧化碳中的氯化氢;
(3) 根据![]() 在水中溶解度小、氨气极易溶于水分析;
在水中溶解度小、氨气极易溶于水分析;
(4)D中脱脂棉的作用是吸收逸出的氨气;
(5)①操作Ⅲ是沉淀与溶液分离;
![]() 装置为制取二氧化碳的装置,仪器a为圆底烧瓶;
装置为制取二氧化碳的装置,仪器a为圆底烧瓶;
![]() 装置的作用为除去二氧化碳中的氯化氢,二氧化碳在饱和碳酸氢钠溶液中溶解度不大,氯化氢能够与碳酸氢钠反应生成二氧化碳,所以B中盛有试剂为饱和碳酸氢钠溶液,选
装置的作用为除去二氧化碳中的氯化氢,二氧化碳在饱和碳酸氢钠溶液中溶解度不大,氯化氢能够与碳酸氢钠反应生成二氧化碳,所以B中盛有试剂为饱和碳酸氢钠溶液,选![]() ;
;
(3)![]() 在水中溶解度小,氨气极易溶于水,则先通
在水中溶解度小,氨气极易溶于水,则先通![]() 至饱和,然后通入二氧化碳气体,有利于
至饱和,然后通入二氧化碳气体,有利于![]() 析出;
析出;
![]() D中脱脂棉的作用是吸收逸出的氨气,浓硫酸能使棉花脱水、浓硝酸具有挥发性,氨气为碱性气体,与硫酸反应,所以选择稀硫酸,选b;
D中脱脂棉的作用是吸收逸出的氨气,浓硫酸能使棉花脱水、浓硝酸具有挥发性,氨气为碱性气体,与硫酸反应,所以选择稀硫酸,选b;
![]() ①测定C中所得晶体的碳酸氢钠的纯度,将晶体充分干燥后,称量质量为wg,此时为碳酸氢钠粗品质量,操作1将晶体加热到质量不再变化时,所得粉末为碳酸钠和杂质,然后溶解,加入氢氧化钡溶液,氢氧化钡跟碳酸钠反应生成碳酸钡,将生成的碳酸钡过滤、洗涤、干燥,称量为
①测定C中所得晶体的碳酸氢钠的纯度,将晶体充分干燥后,称量质量为wg,此时为碳酸氢钠粗品质量,操作1将晶体加热到质量不再变化时,所得粉末为碳酸钠和杂质,然后溶解,加入氢氧化钡溶液,氢氧化钡跟碳酸钠反应生成碳酸钡,将生成的碳酸钡过滤、洗涤、干燥,称量为![]() ,反应的化学方程式为
,反应的化学方程式为![]() ,
,![]() ,得到的碳酸钡需要经过过滤、洗涤、干燥后方可称量,所以操作Ⅲ中的方法是过滤、洗涤、干燥;
,得到的碳酸钡需要经过过滤、洗涤、干燥后方可称量,所以操作Ⅲ中的方法是过滤、洗涤、干燥;
②设样品中碳酸氢钠的质量为x,由上两式可得关系式:
![]()
![]() 197
197
x n
![]() ,
,![]() ,
,
所得晶体中碳酸氢钠的纯度![]() 。
。


科目:高中化学 来源: 题型:
【题目】以电石渣[主要成分为Ca(OH)2和CaCO3]为原料制备KClO3的流程如下:

下列说法正确的是
A.打浆步骤,将电石渣配制成溶液
B.氯化步骤,发生的主要反应2Ca(OH)2 + 2Cl2 = Ca(ClO)2 + CaCl2 +2H2O
C.氯化过程加快氯气的通入速率,有利于提高KClO3的产率
D.KClO3晶体中可能混有 KCl、KClO等杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的个数有( )
①氧原子的电子排布图:![]() 最外层违背了泡利原理
最外层违背了泡利原理
②处于最低能量状态原子叫基态原子,1s22s22px1→1s22s22py1过程中形成的是发射光谱
③所有元素中,氟的第一电离能最大
④具有相同核外电子排布的粒子,化学性质相同
⑤NCl3中N-Cl键的键长比CCl4中C-Cl键的键长短
⑥金属元素的电负性均小于1.8
⑦主族元素的电负性越大,其元素原子的第一电离能一定越大
⑧在任何情况下,都是σ键比π键强度大
A.0个B.1个C.2个D.3个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20ml0.1mol/L氨水溶液中滴加盐酸,溶液中水电离的氢离子浓度随加入盐酸体积变化如图所示。则下列说法正确的是( )
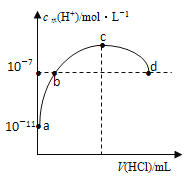
A.b、d两点为恰好完全反应点
B.c点溶液中c(NH4+)=c(Cl-)
C.a、b之间的任意一点:c(Cl-)>c(NH4+),c(H+)>c(OH-)
D.常温下,0.1mol/L氨水的电离常数K约为1×10-5mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用亚硫酸钠固体和70%的浓硫酸制备SO2气体,反应方程式为Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,请设计一套实验装置,收集一试管干燥的SO2气体。
(1)在下面方框中,A表示由分液漏斗和锥形瓶组成的气体发生器,请在答题卡上的A后完成该反应的实验装置示意图(夹持装置、连接胶管不必画出,尾气处理部分必须画出,需要加热的仪器下方用△标出),按气流方向在每件仪器下方标出字母B、C…;其它可选用的仪器(数量不限)简易表示如下:___
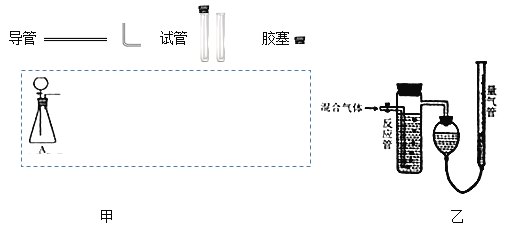
(2)根据方框中的装置图甲,在答题卡上填写下表(可不填满)___
仪器标号 | 仪器中所加物质 | 作用 |
A | 亚硫酸钠、浓硫酸 | 产生SO2 |
(3)某实验小组用如图乙装置测定收集到的气体中SO2的含量,反应管中装有酸性高猛酸钾溶液。
①SO2和酸性高猛酸钾溶液发生反应的离子方程式为:___。
②反应管内溶液紫红色消失后,若没有及时停止通气,则测得的SO2含量___(选填:“偏高”、“偏低”或“无影响”)
③若酸性高猛酸钾溶液体积为V1mL,浓度为cmol/L,量气管内增加的水的体积为V2mL(已折算成标准状况下的体积)。用c、V1、V2表示SO2的体积百分含量为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将镁片、铝片平行插入一定浓度的NaOH溶液中,用导线连成闭合回路,该装置在工作时,下列叙述中正确的是
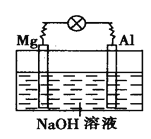
A. 镁比铝活泼,镁失去电子被氧化成Mg2+
B. 铝是电池的负极,开始工作时溶液中会立即有白色沉淀生成
C. 该装置的内、外电路中,均是电子的定向移动形成
D. 该装置开始工作时,铝片表面的氧化膜可不必处理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列有关图象,说法正确的是( )
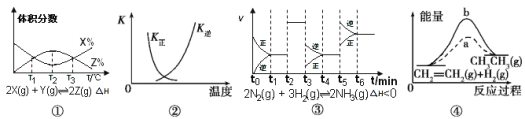
A.由图①知,反应在T1、T3处达到平衡,且该反应的△H<0
B.图②中曲线表示反应2SO2(g)+O2(g) ![]() 2SO3(g),ΔH<0正、逆反应的平衡常数K随温度的变化
2SO3(g),ΔH<0正、逆反应的平衡常数K随温度的变化
C.由图③知,反应在t6时,NH3体积分数最大,t3时采取降低反应温度的措施
D.图④中a、b曲线分别表示反应CH2= CH2(g)+H2(g) ![]() CH3CH3(g) ΔH<0使用和未使用催化剂时, 反应过程中的能量变化
CH3CH3(g) ΔH<0使用和未使用催化剂时, 反应过程中的能量变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第四周期的Cr、Fe、Co、Ni、Cu、Zn等许多金属能形成配合物,单质铁、砷及它们的化合物广泛应用于超导体材料等领域,请回答下列问题:
(1)Fe2+的核外电子排布式为_________________。
(2)NH3是一种很好的配体,NH3的沸点______(填“>”“=”或“<”)AsH3。
(3)N原子核外有______种不同运动状态的电子。基态N原子中,能量最高的电子所占据的原子轨道的形状为___________。
(4)科学家通过X射线测得胆矾结构示意图可简单表示如图,图中虚线表示的作用力为________________。

(5)As的卤化物的熔点如下:
AsCl3 | AsBr3 | AsI3 | |
熔点/K | 256.8 | 304 | 413 |
表中卤化物熔点差异的原因是________________。
(6)向FeCl3溶液中滴入EDTA试剂可得配合物A,其结构如图所示,图中M代表Fe3+,则Fe3+与氮原子之间形成的化学键是_________,Fe3+的配位数为_________。

(7)FeS2晶体的晶胞如图所示。晶胞边长为anm、FeS2相对式量为M、阿伏加德罗常数的值为NA,其晶体密度的计算表达式为_________g·cm-3;晶胞中Fe2+位于S22-所形成的正八面体的体心,该正八面体的边长为_________nm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如图所示的装置制备乙酸乙酯,回答下列相关问题:

(1)连接好装置后,在加入试剂之前需要进行的操作是_________________________。
(2)甲试管中需加入少量____________以防止暴沸。
(3)浓硫酸在反应中的作用是________________________________。
(4)甲试管中发生反应的化学方程式为_______________________________。
(5)乙中导管没有伸入到液面下,原因是________________________________________。
(6)上述实验中饱和碳酸钠溶液的作用是___________(填序号)。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中的溶解度小,有利于分层析出
(7)欲将乙中的物质分离得到乙酸乙酯,采取的实验方法是___________;分离时,乙酸乙酯应该从仪器的__________________(填“下口放出”或“上口倒出”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com