
【题目】将 4 mol A 气体和 2 mol B 气体在 2 L 的容器中混合,并在一定条件下发生如下反应:2A(g)+B(g) ![]() 2C(g)。 若经 2 s 后测得 C 的平均反应速率为 0.3 mol/(L.s) ,下列说法正确的是( )
2C(g)。 若经 2 s 后测得 C 的平均反应速率为 0.3 mol/(L.s) ,下列说法正确的是( )
①用物质 A 表示的反应的平均速率为 0.3 mol/(L.s)
②用物质 B 表示的反应的平均速率为 0.6 mol/(L.s)
③2 s 时物质 A 的转化率为 70%
④2 s 时物质 B 的浓度为 0.7 mol/L
A.①③B.①④C.②③D.③④
科目:高中化学 来源: 题型:
【题目】(1)A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。

①B中Sn极的电极反应式为_______;Sn极附近溶液的pH(填“增大”、“减小”或“不变”)______。
②C中总反应离子方程式为_______________。
③比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是________________。
(2)如图是甲烷燃料电池原理示意图,回答下列问题:

①电池的负极是________(填“a”或“b”)电极,该极的电极反应是:_______________________。
②常温下,如果该原电池电解质溶液为pH=13的氢氧化钠500mL,构成原电池一段时间后pH变为12,则构成原电池消耗了标准状况下__________ mL甲烷,(假设化学能全部转化为电能,忽略氢氧化钠溶液的体积变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某复合肥的主要成分有KCl、NH4H2PO4和CO(NH2)2等。测定该复合肥中氮的质量分数的实验步骤如下:
步骤1:准确称取0.5000 g样品于锥形瓶中,加入足量浓硫酸并加热,不再有CO2溢出时,冷却至室温。
步骤2:向锥形瓶中加入100mL蒸馏水,再加入适量的CaCl2溶液,并用NaOH溶液调节溶液近中性,过滤,洗涤,得0.1550 gCa3(PO4)2沉淀和滤液A。
步骤3:向滤液A中加入过量的甲醛溶液,加指示剂,用0. 5000 mol/LNaOH标准溶液滴定至终点,消耗NaOH溶液22.00 mL。 [已知:4 NH4++6HCHO=4H++(CH2)6N4+6H2O]
(1)步骤1中,CO(NH2)2与硫酸反应的化学方程式为____________________。
(2)欲使滤液A中c(PO43—)≤4.0×10-6mol/L,应保持溶液中c(Ca2+)≥______________mol/L[已知KSP[Ca3(PO4)2]=2.0×10-33]。
(3)复合肥样品中N的质量分数为___________。
(4)计算复合肥样品中NH4H2PO4和CO(NH2)2的物质的量之比_____________(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应A2+3B2![]() 2AB3 以下表示的反应速率中,速率最大的是( )
2AB3 以下表示的反应速率中,速率最大的是( )
A. V(A2)=0.4 molL-1min-1 B. V(B2)=0.8 molL-1min-1
C. V(AB3)=0.6 molL-1min-1 D. V(A2)=0.01 molL-1S-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方法中可以说明2HI(g)![]() H2(g)+I2(g)已达到平衡的是:①单位时间内生成n mol H2的同时生成n mol HI;②一个H–H键断裂的同时有两个H–I键断裂;③百分组成ω(HI)=ω(I2);④反应速率υ(H2)=υ(I2)=1/2υ(HI)时;⑤ c(HI):c(H2):c(I2)=2:1:1时;⑥温度和体积一定时,容器内压强不再变化;⑦温度和体积一定时,某一生成物浓度不再变化;⑧条件一定,混合气体的平均相对分子质量不再变化;⑨温度和体积一定时,混合气体的颜色不再变化;⑩温度和压强一定时,混合气体的密度不再变化。( )
H2(g)+I2(g)已达到平衡的是:①单位时间内生成n mol H2的同时生成n mol HI;②一个H–H键断裂的同时有两个H–I键断裂;③百分组成ω(HI)=ω(I2);④反应速率υ(H2)=υ(I2)=1/2υ(HI)时;⑤ c(HI):c(H2):c(I2)=2:1:1时;⑥温度和体积一定时,容器内压强不再变化;⑦温度和体积一定时,某一生成物浓度不再变化;⑧条件一定,混合气体的平均相对分子质量不再变化;⑨温度和体积一定时,混合气体的颜色不再变化;⑩温度和压强一定时,混合气体的密度不再变化。( )
A. ②③⑤ B. ①④⑦ C. ②⑦⑨ D. ⑧⑨⑩
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】发展储氢技术是氢氧燃料电池推广应用的关键.研究表明液氨是一种良好的储氢物质,其储氢容量可达![]()
![]() 质量分数
质量分数![]() 液氨气化后分解产生的氢气可作为燃料供给氢氧燃料电池.氨气分解反应的热化学方程式如下:
液氨气化后分解产生的氢气可作为燃料供给氢氧燃料电池.氨气分解反应的热化学方程式如下:![]()
请回答下列问题:
![]() 氨气自发分解的反应条件是 ______ .
氨气自发分解的反应条件是 ______ .
![]() 已知:
已知:![]()
![]()
![]()
![]()
则,反应![]()
![]() 的
的![]() ______ .
______ .
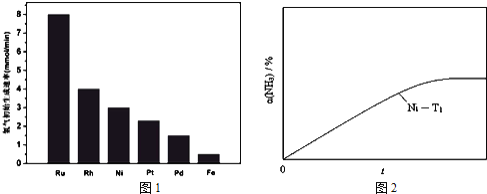
![]() 研究表明金属催化剂可加速氨气的分解.图1为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率.
研究表明金属催化剂可加速氨气的分解.图1为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率.
①不同催化剂存在下,氨气分解反应的活化能最大的是 ______ ![]() 填写催化剂的化学式
填写催化剂的化学式![]() .
.
②恒温![]() 恒容时,用Ni催化分解初始浓度为
恒容时,用Ni催化分解初始浓度为![]() 的氨气,并实时监测分解过程中氨气的浓度.计算后得氨气的转化率
的氨气,并实时监测分解过程中氨气的浓度.计算后得氨气的转化率![]() 随时间t变化的关系曲线
随时间t变化的关系曲线![]() 如图
如图![]() 请在图2中画出:在温度为
请在图2中画出:在温度为![]() ,Ru催化分解初始浓度为
,Ru催化分解初始浓度为![]() 的氨气过程中
的氨气过程中![]() 随t变化的总趋势曲线
随t变化的总趋势曲线![]() 标注
标注![]() ______
______
③如果将反应温度提高到![]() ,请如图2中再添加一条Ru催化分解初始浓度为
,请如图2中再添加一条Ru催化分解初始浓度为![]() 的氨气过程中
的氨气过程中![]() 的总趋势曲线
的总趋势曲线![]() 标注
标注![]() ______
______
④假设Ru催化下温度为![]() 时氨气分解的平衡转化率为
时氨气分解的平衡转化率为![]() ,则该温度下此分解反应的平衡常数K与
,则该温度下此分解反应的平衡常数K与![]() 的关系式是:
的关系式是:![]() ______ .
______ .
![]() 用Pt电极对液氨进行电解也可产生
用Pt电极对液氨进行电解也可产生![]() 和
和![]() 阴极的电极反应式是 ______ ;阳极的电极反应式是 ______
阴极的电极反应式是 ______ ;阳极的电极反应式是 ______ ![]() 已知:液氨中
已知:液氨中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年,我国科学家研发出一种新型的锌碘单液流电池,已知M为阴离子交换膜,其原理如图所示。下列说法不正确的是
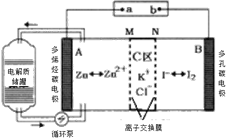
A.放电时A电极反应式为:Zn-2e﹣= Zn2+
B.充电时,B极与外接电源正极相连
C.放电时电解质储罐中离子浓度增大
D.放电时当A极减少65g时,C区Cl﹣增加2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法正确的是
2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法正确的是
A.KClO3在反应中失去电子B.ClO2是氧化产物
C.H2C2O4在反应中被氧化D.1mol KClO3参加反应有2 mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物的描述正确的是( )
A.淀粉、油脂、氨基酸在一定条件下都能水解
B.石油的分馏、煤的液化与气化都是物理变化
C.甲烷与氯气混合光照后,气体颜色变浅,容器内出现油状液滴和白雾
D.苯甲酸的结构简式为![]() ,官能团为羧基和碳碳双键
,官能团为羧基和碳碳双键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com