
Cu(NO3)2是重要的化工原料。回答下列工业生产和化学实验中的几个问题。
(1)实验室欲制备0.3 mol Cu (NO3)2晶体,甲、乙两同学分别设计实验方案如下:
|
 甲:Cu
甲:Cu 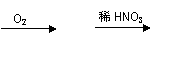 Cu(NO3)2 乙:Cu CuO Cu(NO3)2
Cu(NO3)2 乙:Cu CuO Cu(NO3)2
①从绿色化学的角度分析, 同学的方案更合理,此同学可节约2mol/L的稀硝酸 mL;
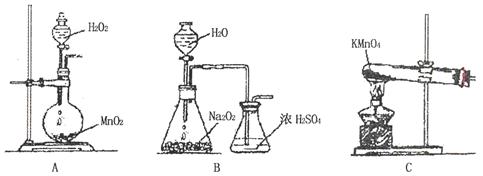
②乙同学实验时通入O2的速率不宜过大,为便于观察和控制产生O2的速率,宜选择
方案(填字母序号)。
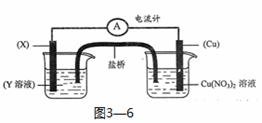
③有下述装置(图3—6),当装置电路中通过2mol电子时,Cu电极(填编号) 。
(a)增重64g (b)减重64g (c)可能增重64g,也可能减重64g
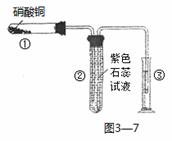
(2)①某校化学兴趣小组的同学对硝酸铜的受热分解进行探究。他们设计了如上图3—7
装置加热Cu(NO3)2固体(加热及夹持装置未画出)。加热过程发现:装置①中的固体逐渐
变为黑色;装置②中有气泡产生,但在上升的过程中消失;石蕊试液逐渐变为红色,液
体几乎不被压至装置③中。请写出Cu(NO3)2受热分解的化学方程式: ;
②在装置中①试管的橡皮塞最好用锡箔包住,原因是 。
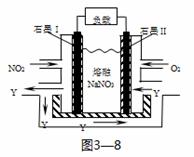
(3)NO2、O2和熔融NaNO3可制作燃料电池,其原理见上图3—8。该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应式为 。
 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:
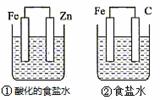 结合右图判断,下列叙述正确的是
结合右图判断,下列叙述正确的是
A.①和②中铁的腐蚀均被加速
B.①和②中负极反应均是Fe-2e-===Fe2+
C.②中碳棒上反应是O2+2H2O+4e-===4OH-
D.①装置中溶液pH会升高,②装置中溶液碱性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
0.2 mol有机物和0.4 mol O2在密闭容器中燃烧后的产物为CO2、CO和H2O(g)。产物经过浓硫酸后,浓硫酸的质量增加10.8 g;再通过灼热CuO充分反应后,固体质量减轻3.2 g;最后气体再通过碱石灰被完全吸收,碱石灰质量增加17.6 g。0.1 mol该有机物恰好与4.6 g金属钠完全反应。下列关于该有机物的说法不正确的是
A.该化合物的相对分子质量是62 B.该化合物的化学式为C2H6O2
C.1 mol该化合物能与2 mol O2发生催化氧化反应[来源:Zxxk.Com]
D.1 mol该有机物最多能与2 mol Na反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关电化学原理的说法错误的是( )
A.氯化铝的熔点比氧化铝低,因此工业上最好采用电解熔融氯化铝来制备单质铝
B.电镀时,通常把待镀的金属制品作阴极,把镀层金属作阳极
C.对于冶炼像钠、钙、镁、铝等这样活泼的金属,电解法几乎是唯一可行的工业方法
D.对大型船舶的外壳进行的“牺牲阳极的阴极保护法”,是应用了原电池原理
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于实验的描述错误的一项是 ( )
A.取5mL 0.1 mol/L KI溶液,滴加0.1mol/LFeCl3溶液5~6滴,继续加入2 mLCCl4,充分振荡,取上层溶液,滴加KSCN溶液,溶液呈现血红色,证明溶液中还存在Fe3+
B.在铁钉的析氢腐蚀实验中,在负极周围加入K3[Fe(CN)6]溶液会出现蓝色沉淀
C.燃料电池实验中,用KNO3溶液或Na2SO4溶液代替蒸馏水,效果要好得多
D.蔗糖的“黑面包”实验中只体现了浓硫酸的脱水性
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质的俗称、主要成分及主要用途对应不正确的是( )
| 俗称 | 醋酸 | 石炭酸 | 福尔马林 | 四氯化碳 |
| 成分 | CH3COOH |
| HCHO | CCl4 |
| 用途 | 调味剂 | 环境消毒 | 防腐剂 | 灭火 |
| 选项 [ | A | B | C | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质的分类都正确的是(括号里的是类别) ( )
A.空气(混合物)、C2H5OH(醇)、H2SO4(离子化合物)、CO2(非电解质)
B.液氨(氢化物)、NH4Cl(铵盐)、HNO3(含氧酸)、NaOH(强电解质)
C.HCl(共价化合物)、CH3COOH(羧酸)、Na2O2(碱性氧化物)、CH3I(卤代烃)
D.NO2(酸性氧化物)、CH3CHO(有机物)、CO(有机物)、CH3COOCH3(酯)
查看答案和解析>>
科目:高中化学 来源: 题型:
“分类”的思想方法,在化学发展中起到了重要作用.下列分类标准合理的是 ( )
A.只含一种元素的物质一定是单质
B.碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物
C.溶于水后能电离出H+的化合物都为酸
D.有单质生成的反应一定是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
有一瓶澄清的溶液,其中可能含有NH4+、K+、 Ba2+、Al3+、Fe3+、 I-、NO3-、CO32-、SO42-、AlO2- 。取该溶液进行以下实验:
①用pH试纸检验,溶液呈强酸性。
②取溶液适量,加入少量CCl4和数滴新制氯水,振荡,CCl4层呈紫红色。
③另取溶液适量,逐滴加入NaOH溶液:a.溶液从酸性变为中性;b.溶液逐渐产生沉淀;c.沉淀完全溶解;d.最后加热溶液,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
④取适量③得到的碱性溶液加入Na2CO3溶液,有白色沉淀生成。
根据上述实验现象,回答下列问题。
(1)由①可以排除 离子的存在。
(2)由②可以证明 离子的存在,同时排除 离子存在。理由是_________________________。
(3)由③可证明 离子存在。
(4)由④可以排除 离子存在,同时证明 离子的存在。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com