
【题目】实验室在500℃时隔绝空气加热硫酸亚铁铵[(NH4)2Fe(SO4)2]至分解完全并确定分解产物成分的装置如图所示(已知分解的固体产物可能有FeO、Fe2O3和Fe3O4,气体产物可能有NH3、N2、H2O、SO3和SO2)。下列说法正确的是( )

A. 装置②用于检验分解产物中是否有水蒸气生成,试剂X最好选用碱石灰
B. 装置③用于检验分解产物中是否有SO3气体生成并除去SO3和NH3
C. 取①中固体残留物与稀硫酸反应并滴加KSCN,溶液变红,则残留物一定为Fe2O3
D. 装置④用于检验分解产物中是否有SO2气体生成,装置⑤用于收集生成的NH3和N2
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】有人设想将碳酸钙通过特殊的加工方法使之变为纳米碳酸钙(碳酸钙粒子直径是几纳米—几十纳米),这将引起建筑材料的性能发生巨变。下列关于纳米碳酸钙的推测可能的是( )
A. 纳米碳酸钙的水溶液会混浊不清
B. 纳米碳酸钙分散到水中能产生丁达尔效应
C. 纳米碳酸钙化学性质已与原来碳酸钙完全不同
D. 纳米碳酸钙的粒子不能透过滤纸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。
请回答下列问题:
(1)煤的气化的主要化学反应方程式为:___________________________。
(2)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:________________________________________。
(3)利用水煤气合成二甲醚的三步反应如下:
① 2H2(g) + CO(g) ![]() CH3OH(g);ΔH = -90.8 kJ·mol-1
CH3OH(g);ΔH = -90.8 kJ·mol-1
② 2CH3OH(g) ![]() CH3OCH3(g) + H2O(g);ΔH= -23.5 kJ·mol-1
CH3OCH3(g) + H2O(g);ΔH= -23.5 kJ·mol-1
③ CO(g) + H2O(g) ![]() CO2(g) + H2(g);ΔH= -41.3 kJ·mol-1
CO2(g) + H2(g);ΔH= -41.3 kJ·mol-1
总反应:3H2(g) + 3CO(g) ![]() CH3OCH3(g) + CO2 (g)的ΔH= ___________;
CH3OCH3(g) + CO2 (g)的ΔH= ___________;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是__________(填字母代号)
a.高温高压 b.加入催化剂 c.减少CO2的浓度
d.增加CO的浓度 e.分离出二甲醚
(4)已知反应②2CH3OH(g) ![]() CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
① 比较此时正、逆反应速率的大小:v正 ______ v逆 (填“>”、“<”或“=”)。
② 若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH) = _________;该时间内反应速率v(CH3OH) = __________。达到平衡时甲醇的转化率α(CH3OH)= _________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“碳呼吸电池”是一种新型能源装置,其工作原理如下图。下列说法正确的是

A. 该装置是将电能转变为化学能
B. 正极的电极反应为:C2O42--2e-=2CO2
C. 每得到1 mol草酸铝,电路中转移3 mol电子
D. 利用该技术可捕捉大气中的CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四元轴烯(a)、苯乙烯(b)、立方烷(c)的分子式均为C8H8,下列说法正确的是( )



A. a的同分异构体只有b和c两种
B. a、c的二氯代物均只有三种,b的一氯代物有五种
C. a、b分子中的所有原子一定处于同一平面
D. a、b、c均能使溴的四氯化碳溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知甲、乙两物质分别由H、C、Na、O、Cl、Fe元素中的一种或几种组成,请按要求填空:
①若甲物质为碱性氧化物,则甲的化学式为___________________(写一种)。
②若乙物质可用于呼吸面具中作为氧气来源,则乙是___________,其供氧原理是__________(用化学方程式表示)。
(2)在横线上填入合适的符号:________+2H+=CO2↑+H2O+Ba2+
(3)写出氯气与水反应的化学方程式,并用双线桥法标出电于转移的方向和数目:______________________________________________________。
(4)选择合适的试剂除去下列括号内的杂质。(填化学式)
物质 | 选择的试剂 |
①FeCl2(FeCl3) | ______ |
②NO气体(NO2) | _____________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种既能提供电能又能固氮的新型氢氮燃料电池的工作原理如图所示,其中电解质溶液为溶有化合物A的稀盐酸。下列有关表述错误的是( )
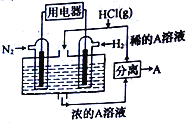
A. 通入N2的电极发生的电极反应式为N2+6e-+8H+=2NH4+
B. 该装置能将化学能转化为电能,化合物A为NH4Cl
C. 电子从通入N2的电极流出,经过用电器流向通入H2的电极
D. 反应过程中电解质溶液的pH会变大,故需要通入氯化氢气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可利用下图中的实验装置测定足量铜与适量一定浓度的浓硝酸反应生成NO和NO2的物质的量之比(用m表示),其中装置C由广口瓶和量气管组成,量气管由甲、乙两根玻璃管组成,用橡皮管连通,并装入适量水,甲管有刻度(0mL~50mL),乙管可上下移动。
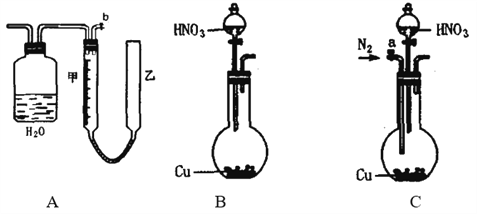
请回答下列问题:
(1)实验中气体(NO和NO2)发生装置应选择___________(填装置序号)。
(2)实验中气体(NO和NO2)通入C装置,请在下图的广口瓶中将导气管画出______。

(3)连接好装置,检查气密性后,应进行的操作:
第一:打开b,向C装置的乙管中加适量水;
第二:_________________________________________________________________________;
第三:将分液漏斗颈上的玻璃塞打开,再将分液漏斗下面的活塞拧开,向烧瓶中加入浓硝酸,与铜反应。
(4)实验前甲、乙两管液面在同一水平面上,最后读数时乙管的液面高于甲管的液面。此时应将乙管_______(填“向上”或“向下”)移动,使________________________。
(5)实验后若量气管中气体的体积(已换算成标准状况)为V(L),C中硝酸的物质的量为n mol,则用含n和V的式子表示m=____________________________(结果可不必化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中生成H2的速率最快的是
金属 | 酸溶液 | 温度 | |
A | Mg | 0.5molL-1H2SO4 | 20℃ |
B | Fe | 1 molL-1HCl | 20℃ |
C | Zn | 2 molL-1HCl | 20℃ |
D | Mg | 1 molL-1H2SO4 | 30℃ |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com