
| A. | 60% | B. | 77.8% | C. | 48.0% | D. | 34.4% |
科目:高中化学 来源: 题型:选择题
| A. | 第二周期 IA族 | B. | 第二周期 VIIA族 | C. | 第三周期 IA族 | D. | 第三周期 VIIA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
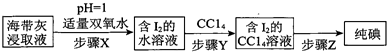
| A. | 步骤X中可用MnO2代替双氧水 | |
| B. | 步骤Y中所用的玻璃仪器一定有分液漏斗 | |
| C. | 步骤Y中可用酒精代替CCl4 | |
| D. | 由于碘易升华,步骤Z中不能采取加热蒸发 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向稀Fe(NO3)2和NaBr混合溶液加入少量稀盐酸:6Br-+8H++2NO${\;}_{3}^{-}$═3Br2+2NO↑+4H2O | |
| B. | 往NH4Al(SO4)2溶液中滴加Ba(OH)2溶液加热,刚好使NH4+全部转化为NH3:NH4++Al3++SO42-+Ba2+4OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+Al(OH)3↓+BaSO4+H2O | |
| C. | 碳酸钠溶液呈碱性:CO32-+2H2O?H2CO3+2OH- | |
| D. | 用氢氧化钠溶液去除铝条表面的氧化膜:Al2O3+2OH-═2AlO2-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
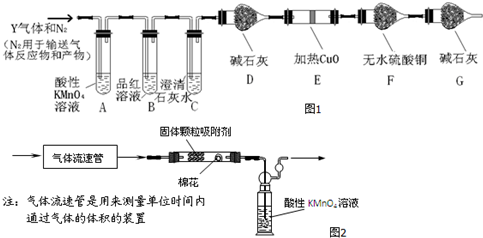
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

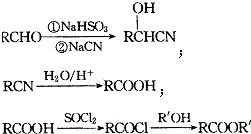 ;
;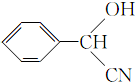 ;
; ;
;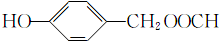 (填结构简式).
(填结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
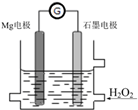 Mg-H2O2电池是一种化学电源,以Mg和石墨为电极,海水为电解质溶液,示意图如下.下列说法不正确的是( )
Mg-H2O2电池是一种化学电源,以Mg和石墨为电极,海水为电解质溶液,示意图如下.下列说法不正确的是( )| A. | 石墨电极是该电池的正极 | |
| B. | 石墨电极上发生还原反应 | |
| C. | Mg电极的电极反应式:Mg-2e-=Mg2+ | |
| D. | 电池工作时,电子从Mg电极经导线流向石墨电极,再出石墨电极经电解质溶液流向Mg电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液至SO42-恰好沉淀完全:2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O | |
| B. | 向苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| C. | 氧化亚铁溶于稀硝酸:3FeO+8H++NO3-═3Fe3++NO↑+4H2O | |
| D. | 将0.4 mol•L-1的NaAlO2溶液和0.7 mol•L-1的盐酸等体积混合:4AlO${\;}_{2}^{-}$+7H++H2O═3Al(OH)3↓+Al3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com