
| 元素 | 相关信息 |
| X | 第二层的电子数是第一层电子数的3倍 |
| Y | 元素的原子中没有中子 |
| Z | 第二层电子数是第一层和第三层电子数之和 |
| X、W、M | X2-、W2+、M3+具有相同的电子层结构 |
 .
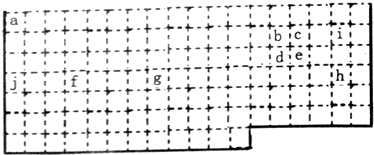
.分析 (1)由元素在周期表中的位置可知,a为H、b为C、c为N、d为Si、e为P、f为Ti、g为Fe、h为Br、i为F、j为K.
①常温下溴单质为液态;金属性越强,最高价氧化物对应水化物的碱性越强;二氧化硅用作制光导纤维;e处于第15列,为VA族元素;
②长周期中第3~12列为过渡元素;由f的位置可知,其处于第四周期ⅣB族;
③主族元素中O、F除外,其它元素的最高正化合价等于其族序数;氮元素最高价氧化物的水化物和其氢化物能发生化合反应生成硝酸铵;
(2)X元素原子第二层的电子数是第一层电子数的3倍,第二层电子数为6,则X为O元素;Y元素的原子中没有中子,则Y为H元素;Z元素原子第二层电子数是第一层和第三层电子数之和,则第三层电子数为8-2=6,故Z为S;X2-、W2+、M3+具有相同的电子层结构,则W为Mg、M为Al.
①W2+离子为Mg2+,质子数为12,核外电子数为10,各层电子数为2、8;
②Al分别与过量的强酸和强碱反应生成氢气,根据电子转移守恒可知生成氢气相等;
③利用单质之间的相互置换反应能说明X单质的氧化性比Z单质的氧化性;
④Z形成的两核18电子微粒为HS-,X形成的两核10电子微粒为OH-,二者反应生成S2-与H2O.
解答 解:(1)由元素在周期表中的位置可知,a为H、b为C、c为N、d为Si、e为P、f为Ti、g为Fe、h为Br、i为F、j为K.
①常温下Br2单质为液态;K的金属性最强,故KOH的碱性最强,硅的氧化物--二氧化硅用作制光导纤维;e处于第15列,为VA族元素,最外层电子数为5,
故答案为:Br2;K;硅;5;
②长周期中第3~12列为过渡元素,上述元素中属于过渡元素的有fg;由f的位置可知,其处于第四周期ⅣB族,
故答案为:fg;第四周期ⅣB族;
③主族元素中O、F除外,其它元素的最高正化合价等于其族序数,第二周期中,最高正价和主族序数相等的元素符号为C、N;氮元素最高价氧化物的水化物和其氢化物能发生化合反应生成硝酸铵,反应方程式为:NH3+HNO3=NH4NO3,
故答案为:C、N;NH3+HNO3=NH4NO3;
(2)X元素原子第二层的电子数是第一层电子数的3倍,第二层电子数为6,则X为O元素;Y元素的原子中没有中子,则Y为H元素;Z元素原子第二层电子数是第一层和第三层电子数之和,则第三层电子数为8-2=6,故Z为S;X2-、W2+、M3+具有相同的电子层结构,则W为Mg、M为Al.
①W2+离子为Mg2+,质子数为12,核外电子数为10,各层电子数为2、8,离子结构示意图为: ,
,
故答案为: ;
;
②Al分别与过量的强酸和强碱反应生成氢气,根据电子转移守恒可知生成氢气相等,即生成氢气物质的量之比为1:1,
故答案为:1:1;
③能说明氧气的氧化性比硫的氧化性强的化学方程式为:O2+2H2S=2S↓+2H2O,
故答案为:O2+2H2S=2S↓+2H2O;
④Z形成的两核18电子微粒为HS-,X形成的两核10电子微粒为OH-,二者反应生成S2-与H2O,反应离子方程式为:HS-+OH-=S2-+H2O,
故答案为:HS-+OH-=S2-+H2O.
点评 本题考查结构性质位置关系应用,熟练掌握元素周期表结构与元素周期律,有利于对基础知识的巩固.


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:选择题
| A. | Cu2+、Na+、SO42-、NO3- | B. | K+、Na+、HCO3-、NO3- | ||
| C. | OH-、HCO3-、Ba2+、Na+ | D. | H+、Fe2+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | P4和CO2中只含有共价键 | |
| B. | CCl4和NH3的立体构型都是正四面体 | |
| C. | BF3中各原子均达到8电子的稳定结构 | |
| D. | 甲烷是对称的平面形结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12C和C60属于同一种元素,互为同素异形体 | |
| B. | 16O和18O是不同的核素,互为同位素 | |
| C. | 37Cl和35Cl可以通过化学变化实现相互转化 | |
| D. | H2O和H2O2由同种元素组成,二者互为同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 温度 | 物质的量 | 催化剂 |
| A | 400℃ | 8mol SO2和5mol O2 | 无 |
| B | 400℃ | 10mol SO2和5mol O2 | 无 |
| C | 450℃ | 10mol SO2和5mol O2 | V2O5作催化剂 |
| D | 450℃ | 8mol SO2和5mol O2 | 无 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 灼热的炭与CO2的反应既是氧化还原反应,又是放热反应 | |
| B. | Ba(OH)2•8H2O与NH4Cl的反应是放热反应 | |
| C. | 化学键的断裂和形成是物质在化学反应中发生能量变化的主要原因 | |
| D. | 反应物的总能量大于生成物的总能量的反应是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应速率与I2的浓度有关 | |
| B. | HI也是该反应的催化剂 | |
| C. | 反应焓变的绝对值等于190kJ•mol-1 | |
| D. | v(CH4)>v(CH3CHO)=v(CO) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com