
【题目】实验室用燃烧法测定某固体有机物A的分子组成,测定装置如图所示(铁架台、铁夹、酒精灯等未画出):
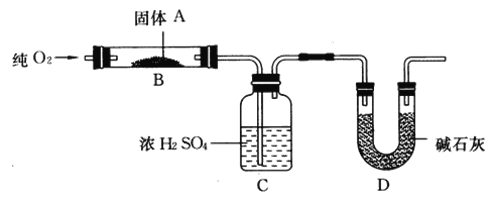
取17.1 g A放入B装置中,通入过量O2燃烧,生成CO2和H2O,请回答下列有关问题:
(1)通入过量O2的目的是________。
(2)C装置的作用是________;D装置的作用是________。
(3)通过该实验,能否确定A中是否含有氧元素? ___________________。
(4)若A的摩尔质量为342 g/mol,C装置增重9.9 g,D装置增重26.4 g,则A的分子式为_____。
(5)写出A燃烧的化学方程式:__________________。
(6)A可发生水解反应,1 mol A可水解生成2 mol同分异构体,则A在催化剂作用下水解的化学方程式为________________________。
【答案】使有机物A充分燃烧 吸收A燃烧后生成的H2O 吸收A燃烧后生成的CO2 能确定 C12H22O11 C12H22O11+12O2![]() 12CO2+11H2O C12H22O11+H2O
12CO2+11H2O C12H22O11+H2O![]() C6H12O6+C6H12O6
C6H12O6+C6H12O6
【解析】
(1)有机物在氧气中燃烧生成二氧化碳和水;
(2)浓硫酸吸收水,碱石灰吸收二氧化碳;
(3)根据质量守恒计算判断;
(4)根据浓硫酸和碱石灰增重的质量可计算有机物生成的水和二氧化碳的物质的量,根据C元素、H元素守恒和O元素守恒可计算有机物中C、H、O元素的物质的量,进而计算各元素的物质的量之比,最终可计算有机物的分子式;
(5)C12H22O11在氧气中燃烧生成二氧化碳和水;
(6)A可发生水解反应,1mol A可水解生成2mol同分异构体,则A为蔗糖,蔗糖水解生成葡萄糖和果糖。
(1)燃烧法测定某固体有机物A的分子组成,要通入过量O2使有机物在氧气中充分燃烧生成二氧化碳和水;
(2)C装置中的试剂为浓硫酸,用于吸收有机物燃烧生成的水,D装置中的试剂是碱石灰用于吸收有机物燃烧生成的二氧化碳;
(3)通过浓硫酸增重的质量可以求出有机物中氢的质量,通过碱石灰增重的质量可以求出有机物中碳的质量,再根据A的质量判断是否有氧元素;
(4)浓硫酸增重可知水的质量为9.9g,可计算出n(H2O)=![]() =0.55mol,n(H)=1.1mol,m(H)= 1.1mol ×1g/mol=1.1g;使碱石灰增重26.4g,可知二氧化碳质量为26.4g,n(C)=n(CO2)=
=0.55mol,n(H)=1.1mol,m(H)= 1.1mol ×1g/mol=1.1g;使碱石灰增重26.4g,可知二氧化碳质量为26.4g,n(C)=n(CO2)=![]() =0.6mol,m(C)= 0.6mol ×12g/mol=7.2g,m(C)+m(H)=8.3g,有机物的质量为17.1g,所以有机物中氧的质量为=17.1g-8.3= 8.8g,n(O)=
=0.6mol,m(C)= 0.6mol ×12g/mol=7.2g,m(C)+m(H)=8.3g,有机物的质量为17.1g,所以有机物中氧的质量为=17.1g-8.3= 8.8g,n(O)=![]() =0.55mol,n(C):n(H):n(O)=0.6mol:1.1mol:0.55mol≈12:22:11,即实验式为C12H22O11,A的摩尔质量为342g/mol,所以分子式也为C12H22O11;
=0.55mol,n(C):n(H):n(O)=0.6mol:1.1mol:0.55mol≈12:22:11,即实验式为C12H22O11,A的摩尔质量为342g/mol,所以分子式也为C12H22O11;
(5)C12H22O11在氧气中燃烧生成二氧化碳和水,其反应的方程式为:C12H22O11+12O2![]() 12CO2+11H2O;
12CO2+11H2O;
(6)A可发生水解反应,1mol A可水解生成2mol同分异构体,则A为蔗糖,蔗糖水解生成葡萄糖和果糖,其在催化剂作用下水解的化学方程式为C12H22O11(蔗糖)+H2O![]() C6H12O6(葡萄糖)+C6H12O6(果糖)。
C6H12O6(葡萄糖)+C6H12O6(果糖)。


科目:高中化学 来源: 题型:
【题目】W、X、Y、Z、N、M六种主族元素,它们在周期表中位置如图所示,下列说法不正确的是
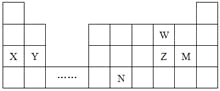
A. 原子半径:Y>Z>W
B. 单质的还原性:X>Y
C. 溴与元素M同主族,最高价氧化物的水化物的酸性比M的强
D. 元素N位于金属与非金属的分界线附近,可以推断N元素的单质可作半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种重要的杀菌消毒剂。以氯酸钠(NaC1O3)为原料 制备NaC1O2粗品的工艺流程如下图所示。

己知:①纯C1O2易分解爆炸,空气中C1O2的体积分数在10%以下比较安全。
②NaClO2高于60°C会分解。
(1)反应I的离子方程式为____;反应中需同时鼓入空气的主要目的是____ °
(2)“合成”过程中的氧化剂是______。
(3)蒸发时,需要减压的目的是_____。
(4)“冷却结晶”后获得NaClO,粗产品的操作是_____(填操作名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1100℃,一定容积的密闭容器中发生反应:FeO(s)+CO(g) ![]() Fe(s)+CO2(g) △H=a kJ/mol(a >0),该温度下K=0.263,下列有关该反应的说法正确的是( )
Fe(s)+CO2(g) △H=a kJ/mol(a >0),该温度下K=0.263,下列有关该反应的说法正确的是( )
A. 若生成1 mol Fe,则吸收的热量小于a kJ
B. 若升高温度,正反应速率加快,逆反应速率减慢,则化学平衡正向移动
C. 若容器内压强不随时间变化,则可以判断该反应已达到化学平衡状态
D. 达到化学平衡状态时,若c(CO)=0.100 mol/L,则c(CO2)=0.0263 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置的说法中正确的是( )

A.用图1装置可以实现化学能持续转化为电能
B.放出图2装置中全部液体,体积为42.00 mL
C.用图3装置可以制备少量氢氧化铁胶体
D.用图4装置可以检验乙醇脱水后有乙烯生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷是一种清洁能源,下列有关说法正确的是( )
A.一定温度下,反应CO2(g)+4H2(g)=CH4(g)+2H2O(g)能自发进行,该反应的ΔH>0
B.碱性甲烷-空气燃料电池的负极反应为CH4-8e-+10OH-=CO![]() +7H2O
+7H2O
C.标准状况下,5.6LCH4在空气中完全燃烧,转移电子的数目约为2.408×1024
D.甲烷和微生物共同作用可以实现城市废水脱氮处理,反应温度越高,脱氮速率越快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用加热铵盐和碱的混合物的方法制取氨气。
(1)写出图中大试管中发生反应的化学方程式 ______________________________。
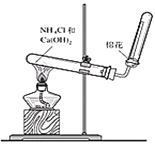
(2)收集氨气时,判断氨气是否收集满可采用的方法是_________________________。
(3)也可利用加热浓氨水的方法制取少量的氨气,此法利用了氨水的________性质。将收集满氨气的烧瓶组装成如图所示的装置。
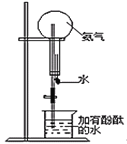
当挤压胶头滴管,使少量的水进入烧瓶,打开弹簧夹可以观察到的现象是:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)可作为照相业的定影剂,反应的化学方程式为:AgBr+2Na2S2O3=Na3[Ag(S2O3)2]+NaBr。下列说法正确的是
A.基态Br原子中电子的空间运动状态有35种B.[Ag(S2O3)2]3-中含有离子键、共价键、配位键
C.![]() 中心原子S的杂化方式为sp3D.非金属元素S、O、Br中电负性最大的是Br
中心原子S的杂化方式为sp3D.非金属元素S、O、Br中电负性最大的是Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、Q、R为短周期元素,其原子半径和最外层电子数之间的关系如图所示。下列说法错误的是
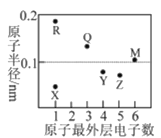
A.R不能把Q从其盐溶液中置换出来
B.X、R、Q三种元素可以构成离子化合物
C.热稳定性:ZX3<YX4
D.X2M的水溶液露置于空气中易变质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com