
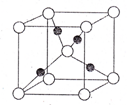
 A、B、C、D、E为前四周期中原子序数依次增大的元素,相关的信息如下:
A、B、C、D、E为前四周期中原子序数依次增大的元素,相关的信息如下:| 元素 | 相关信息 |
| A | A元素原子核外只有三个能级,且每个能级上含有相等的电子数 |
| B | B在短周期元素中外围电子具有最多的未成对电子 |
| C | 短周期中,C的最高价氧化物对应水化物M碱性最强 |
| D | 基态原子第三能层上有7种运动状态不同的电子 |
| E | 一种核素的质量数为63,中子数为34 |
| 5-1×3 |
| 2 |
| 1 |
| 8 |
| 4×64+2×16 |
| NA |
| 4×64+2×16 |
| NA |
| 288 |
| a3NA |
| 288 |
| a3NA |


科目:高中化学 来源: 题型:

| A、该物质的分子式为C16H16O3 |
| B、该物质分子内所碳原子有可能在同一平面内 |
| C、该物质可发生加成、取代、氧化等反应 |
| D、该物质可使酸性高锰酸钾溶液和溴水褪色,且原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、苯和乙烯都可以使得溴的四氯化碳溶液褪色 |
| B、等物质的量的乙烯和乙醇完全燃烧消耗氧气的量不相等 |
| C、乙醇的酯化反应和酯的水解反应均属于取代反应 |
| D、聚乙烯可以发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、盐酸中:K+、Mg2+、Fe2+、MnO4-、 |
| B、NaOH溶液中:Cu2+、NH4+、SO42-、CO32- |
| C、FeCl3溶液中:Al3+、Na+、SCN-、SO42- |
| D、NaClO溶液中:K+、SO42-、OH-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解过程中流经外电路的电子数目为0.1NA |
| B、在标准状况下,两极共产生3.92L气体 |
| C、电解后溶液的pH为2(假设溶液体积不变) |
| D、加入13.8g Ag2CO3可将溶液彻底复原 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 25℃时,将pH均为2的HCl与HX的溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示.下列说法正确的是( )
25℃时,将pH均为2的HCl与HX的溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示.下列说法正确的是( )| A、稀释前,c(HX)=0.01 mol/L |
| B、稀释10倍,HX溶液的pH=3 |
| C、a、b两点:c(X-)>c(Cl-) |
| D、溶液的导电性:a>b |
查看答案和解析>>
科目:高中化学 来源: 题型:
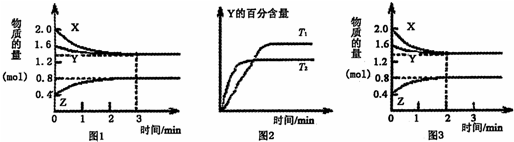
| A、容器中发生的反应可表示为:3X(g)+Y(g)?4Z(g) |
| B、0-3 min内,v(X)=0.2 mol?L-1?min-1 |
| C、若改变条件,使反应进程如图3所示,则改变的条件可能是增大压强 |
| D、其他条件不变升高温度,v正、v重都增大,且重新达到平衡前v正>v重 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸性KMnO4溶液与H2O2反应:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O |
| B、向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl- |
| C、向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+ |
| D、(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-=Fe(OH)2↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com