
【题目】下列物质中属于强电解质的是
A.NH3·H2OB.CH3COOHC.NaClD.H2O
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】乙二酸(HOOC—COOH)也称草酸,是一种重要的化工原料和化工产品。利用石油化工产品中的烷烃可以生成草酸,生产流程如下:
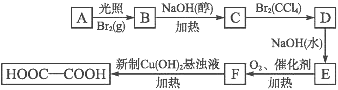
已知上述框图中有机物B的相对分子质量比有机物A的相对分子质量大79。
请回答下列问题:
(1)A的结构简式是_______________;D的名称__________________。
(2)写出有关的化学方程式:
B→C:________________________________________________________。
D→E:________________________________________________________。
(3)A生成B的反应类型是__________;C生成D的反应类型是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有HCO3-、SO32- 、CO32-、CH3COO-等4种阴离子。向其中加入足量的Na2O2固体后,溶液中离子浓度基本保持不变的是(假设溶液体积无变化)( )
A. CH3COO- B. SO32- C. CO32- D. HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、对N2(g)+3H2(g)![]() 2NH3(g) ΔH<0反应,其他条件不变情况下,改变起始氢气物质的量(用n(H2)表示),实验结果如下如图表示(图中T表示温度,n表示物质的量);
2NH3(g) ΔH<0反应,其他条件不变情况下,改变起始氢气物质的量(用n(H2)表示),实验结果如下如图表示(图中T表示温度,n表示物质的量);
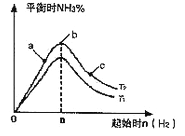
(1)比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是______.
(2)若容器容积为1L,n=5mol,T2条件下反应达到平衡时H2的转化率为60%,则且H2与N2物质的量之比为1:1,则在起始时体系中加入N2的物质的量为______mol,反应的平衡常数K=______.
Ⅱ、煤制天然气的工艺流程如图所示:

(3)反应Ⅰ:C(s)+H2O(g) ![]() CO(g)+H2(g) ΔH=+135kJ/mol,
CO(g)+H2(g) ΔH=+135kJ/mol,
①通入的氧气会与部分碳发生燃烧反应。请利用能量转化及配合移动原理说明通入氧气的作用:_______。
②若反应Ⅰ在体积不变的密闭容器中进行,下列能说明反应Ⅰ达到平衡状态的是________。
a.压强不变 b.气体密度不变 c.气体平均摩尔质量不变 d.氢气浓度不变
(4)反应Ⅱ:C0(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH=-41kJ/mol。如图3表示不同温度条件下,煤气化反应Ⅰ发生后的汽气比(水蒸气与CO物质的量之比)与CO平衡转化率的变化关系。
CO2(g)+H2(g) ΔH=-41kJ/mol。如图3表示不同温度条件下,煤气化反应Ⅰ发生后的汽气比(水蒸气与CO物质的量之比)与CO平衡转化率的变化关系。
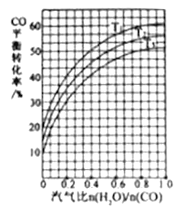
①判断T1、T2和T3的大小关系:________。(从小到大的顺序)
②若煤气化反应Ⅰ发生后的汽气比为0.8,经煤气化反应Ⅰ和水气变换反应Ⅱ后,得到CO与H2的物质的量之比为1:3,则反应Ⅱ应选择的温度是_________(填“T1”或“T2”或“T3”)。
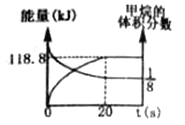
(5)实验室模拟甲烷化反应:一定条件下,向体积为2L的恒容密闭容器中充入1.2molCH4(g)和4.8molCO2(g),发生反应CH4(g)+3CO2(g) ![]() 2H2O(g)+4CO(g) ΔH>0,实验测得,反应吸收的能量和甲烷的体积分数随时间变化的曲线图像如图。计算该条件下,20s内v(CH4)=______,此反应的ΔH =_____。
2H2O(g)+4CO(g) ΔH>0,实验测得,反应吸收的能量和甲烷的体积分数随时间变化的曲线图像如图。计算该条件下,20s内v(CH4)=______,此反应的ΔH =_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活(选修模块)(1)去年我国出现大范围雾霾天气,许多城市发布PM2.5重度污染警报。
① 下列行为不会增加城市大气中PM2.5浓度的是______(填字母)。
a. 燃放烟花爆竹 b. 为城市主干道洒水保洁 c. 露天焚烧落叶
② 雾霾会刺激呼吸道,使人易患流行性感冒。感冒发烧病人可服用_______药品进行治疗(填字母)。
a. 麻黄碱 b. 抗酸药 c. 阿司匹林
③ 多食富含维生素C的蔬菜水果可增强人的免疫力。维生素C具有的性质是_______(填字母)。
a. 还原性 b. 常温下不溶于水 c. 溶液显碱性
(2)今年1月12日,我国3名潜水员圆满完成首次300米饱和潜水作业,实现“下五洋捉鳖”的壮举。
① 潜水员乘坐的潜水钟以钢铁为主要制造材料。钢铁容易在潮湿空气中发生电化学腐蚀,其负极的电极反应式是__________________。
② 潜水员需要均衡的膳食结构。糖类、油脂、蛋白质都能为人体提供能量。油脂在人体中发生水解生成________ 和高级脂肪酸;蛋白质在酶的作用下水解生成__________而被人体吸收。
(3)著名物理化学家张存浩院士获得2013年国家最高科学技术奖,他在氟化氢(氘)激光器和水煤气合成液体燃料研究等方面做出了重要贡献。
① 氢氟酸(HF)是一种弱酸,写出HF的电离方程式_________________________。
② 水煤气的主要成分是CO和H2,在40MPa、380℃、锌铬氧化物做催化剂的条件下,用CO和H2合成液体燃料CH3OH,该反应的化学方程式为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素的单质和化合物性质判断元素非金属性强弱的依据是
①元素最高价氧化物的水化物的碱性强弱 ②元素最高价氧化物的水化物的酸性强弱
③元素单质跟酸反应置换出氢的难易 ④元素单质跟氢气生成气态氢化物的难易
A.①②③④ B.③④ C.①②④ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】品味生活,感知化学
(1)“美食名粽,品位海南”,2017年5月20日海南名粽展销会拉开帷幕。海南粽子的主要食材有:糯米、猪肉、咸蛋黄等。
①以上食材中富含淀粉的是________________;
②从平衡膳食的角度看,吃海南粽子时,还应补充适量的_____________(填营养素名称);
③海南粽子经过真空包装,并添加一定的抗氧化剂后销往各地,抗氧化剂所起的作用是________________
(填“着色”或“防腐”或“调味”);
④粽叶一般选择新鲜的植物叶子,剥下的粽叶为实现无害化、资源化处理,写出一种合理的处理方法_________________________。
(2)下图是一辆大气环境监测汽车,请回答下列问题:

①汽车轮胎所用的主要材料是_________________。
②汽车外壳会喷上各种颜色的油漆,一方面能起到美化作用,另一方面油漆还能为钢铁材料起到________________作用;
③汽车的内饰材料若不合格,易产生一些挥发性有毒物质如________(填“甲醛”或“甲烷”或“乙醇”)而对车内空气造成污染;
④目前,大气环境监测公布的主要污染物有硫的氧化物、氮的氧化物和________(填字母)。
a.二氧化碳 b.氮气 c.可吸入颗粒物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁加热至高温会分解,生成—种金属氧化物M和两种非金属氧化物。某化学研究小组利用下列装置加热至高温使FeSO4分解。
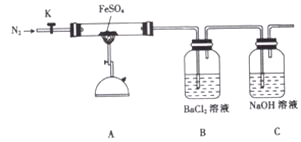
实验步骤:
将一定量FeSO4固体置于硬质玻璃管中,打开活塞K,通入一段时间N2,关闭活塞K。加热A中的玻璃管一段时间,待A中固体不再分解后,停止加热,打开K,缓慢通入氮气至玻璃管冷却。
(1)已知M中铁元素的质量分数为70%,M的化学式为_____________。
(2)按图组装好仪器(已省略夹持仪器)并检查装置的气密性,在一定温度下按上述图示装置进行实验。
操作步骤 | 实验现象 | 用方程式解释原因 |
打开K,通入一段时间N2,关闭K。加热A中玻璃管一段时间 | 洗气瓶B中①__________ | ②______________ |
A中固体不再分解后,停止加热,打开K,缓慢通入N2至玻璃管冷却 | 硬质玻璃管最终可以看到③_______________ | ④______________ |
(3)某同学欲验证硫酸亚铁分解产物中含有的另一种非金属氧化物N。
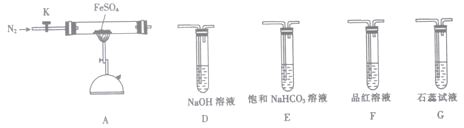
①从实验装置D、E、F、G中,选用两个装置与装置A连接进行实验,依次连接的合理顺序为A→______→______。
②能证明生成了非金属氧化物N的现象是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com