
【题目】分类是学习和研究化学的一种重要方法,下列分类合理的是( )
A.Na2O和Na2O2都属于碱性氧化物B.SO3和SO2都属于酸性氧化物
C.漂白粉和CuSO45H2O都属于混合物D.烧碱和纯碱都属于碱
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
【题目】元素X的原子核外M电子层上有3个电子,元素Y的离子Y2核外有18个电子,则这两种元素可形成的化合物为( )
A.XY2B.X2Y3C.X3Y2D.X2Y2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把含硫酸铵和硝酸铵的混合液a L分成两等份.一份加入含b mol NaOH的溶液并加热,恰好把NH3全部赶出;另一份需消耗c mol BaCl2才能使SO42﹣完全沉淀,则原溶液中NO3﹣的物质的量浓度为( )
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向10mL 1 mol·L-1的HCOOH溶液中不断滴加1 mol·L-1的NaOH溶液,并一直保持常温,所加碱的体积与-lg c水(H+)的关系如图所示。c水(H+)为溶液中水电离的c(H+)。下列说法不正确的是

A. 常温下,Ka(HCOOH)的数量级为10-4
B. a、b两点pH均为7
C. 从a点到b点,水的电离程度先增大后减小
D. 混合溶液的导电性逐渐增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢H2O2(氧的化合价为﹣1价),俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。对于下列A~D涉及H2O2的反应,填写空白:
A.Na2O2+2HCl===2NaCl+H2O2
B.Ag2O+H2O2===2Ag+O2↑+H2O
C.2H2O2===2H2O+O2 ↑
D.3H2O2+Cr2(SO4)3+10KOH===2K2CrO4+3K2SO4+8H2O
(1)H2O2仅体现氧化性的反应是_________(填代号);H2O2既体现氧化性又体现还原性的反应是_________(填代号)。
(2)在稀硫酸中,KMnO4和H2O2能发生氧化还原反应。
氧化反应:H2O2﹣2e﹣===2H++O2↑
还原反应:MnO4-+5e﹣+8H+===Mn2++4H2O
写出该氧化还原反应的离子方程式:___________________。
(3)上面实验中用到一定物质的量浓度的稀硫酸,若配制1mol/L的稀硫酸溶液480mL,需用18mol/L浓H2SO4____mL,配制中需要用到的主要玻璃仪器是(填序号)______。A.100mL量筒 B.托盘天平 C.玻璃棒 D.100mL容量瓶 E.50mL 量筒 F.胶头滴管 G.烧杯 H.500mL容量瓶
(4)下面操作造成所配稀硫酸溶液浓度偏高的是______________
A.溶解后溶液没有冷却到室温就转移
B.转移时没有洗涤烧杯、玻璃棒
C.向容量瓶加水定容时眼睛俯视液面
D.用量筒量取浓硫酸后洗涤量筒并把洗涤液转移到容量瓶
E.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
(5)如图是一种用电解原理来制备H2O2,并用产生的H2O2处理废氨水的装置。
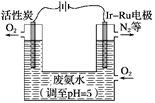
①为了不影响H2O2的产量,需要向废氨水中加入适量HNO3调节溶液的pH约为5,则所得溶液中c(NH4+)________(填“>”“<”或“=”)c(NO3-)。
②Ir-Ru惰性电极吸附O2生成H2O2,其电极反应式为:______________________。
③理论上电路中每转移3 mol e-,最多可以处理废氨水中溶质(以NH3计)的质量是________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作正确的是( )
A.用灼热的氧化铜除去CO2中混有的少量CO
B.用NaOH溶液除去SO2中混有的HCl
C.用100mL量筒量取8.53mL蒸馏水
D.为加快过滤速度,可用玻璃棒在漏斗中搅拌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示的四个原电池装置,其中结论正确的是( )
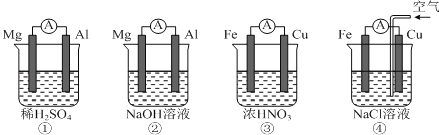
A. ①中Mg作负极,电子流向:Mg→稀硫酸→Al
B. ②中Al作负极,OH迁移方向:Al→外电路→Mg
C. ③中Fe作正极,电极反应式:2H++2e═H2↑
D. ④中Cu作正极,电极反应式:O2+4e+2H2O═4OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分短周期元素原子半径的相对大小、最高正价或最低负价随原子序数的变化关系如图所示:

下列说法正确的是
A. 离子半径的大小顺序:e>f>g>h
B. 与x形成简单化合物的沸点:y>z>d
C. x、z、d三种元素形成的化合物可能含有离子键
D. e、f、g、h四种元素对应最高价氧化物的水化物相互之间均能发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法正确的是
A. 16 g O2和O3的混合气体中含有的分子数为0.5NA
B. 0.3 mol AgNO3受热完全分解(2AgNO3===2Ag+2NO2↑+O2↑),用排水法收集到气体的分子数为 0.25NA
C. 100 mL 12 mol·L-1浓盐酸与足量MnO2共热,生成的Cl2分子数为0.3NA
D. 2.3 g金属钠在装有氧气的集气瓶中完全燃烧,转移的电子数为0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com