
��һ�������£���Ӧ��2NO��O2 2NO2�ڶ��������з������Ը÷�Ӧ�ﵽƽ��ı�־�������У��������
2NO2�ڶ��������з������Ը÷�Ӧ�ﵽƽ��ı�־�������У��������
�ٻ��������ܷ��������ٱ仯 �ڻ���������ɫ���ٱ仯 ����������ѹǿ���ٱ仯 �ܻ����������������ٱ仯 �ݻ��������ܶȲ��ٱ仯 ��λʱ��������n mol��NO��ͬʱ����n mol��NO2 �߷�Ӧ���¶Ȳ��ٷ����仯(��������)
| A���٢ڢۢ� | B���ܢݢ� | C���٢ڢ� | D���ۢߢݢ� |
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
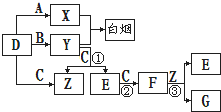
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��2013?���죩��E��F�����ܱ������У���һ�������·�����Ӧ��E��g��+F��s��?2G��g�������Թ��������ƽ��ʱG�����������%�����¶Ⱥ�ѹǿ�ı仯���±���ʾ��
�۸÷�Ӧ�ġ�S��0 ��K��1000�棩��K��810�棩 �����١�������ȷ���У������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com