
【题目】在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH ![]() CH3COO-+H+ ΔH>0。
CH3COO-+H+ ΔH>0。
(1)25 ℃时,浓度均为0.1mol/L的盐酸和醋酸溶液,下列说法正确的是___________;
①两溶液的pH相同
②两溶液的导电能力相同
③由水电离出的c(OH-)相同
④中和等物质的量的NaOH溶液,消耗两溶液的体积相同
(2)25℃时,pH =5的稀醋酸溶液中,由水电离的c(OH-)=____________mol·L-1 ,c(CH3COO-)=_____________mol·L-1 (填数字表达式);
(3)25 ℃时,向pH均为1的盐酸和醋酸溶液中分别加水,随加水量的增多,两溶液pH的变化如图所示,则符合盐酸pH变化的曲线是_______________;

(4)25 ℃时,向体积为Va mLpH=3的醋酸溶液中滴加pH=11的NaOH溶液Vb mL至溶液恰好呈中性,则Va与的Vb关系是Va________________Vb(填“>”、“<”或“=”)。
(5)25 ℃时,若向氨水中加入稀盐酸至溶液的pH=7,此时c(NH4+)=a mol/L,则c(Cl-)=________ mol/L。
【答案】④ 10-9mol/L 10-5-10-9mol/L Ⅰ < amol/L
【解析】
(1)①CH3COOH是弱电解质,HCl是强电解质,等浓度的两种溶液中盐酸中c(H+)大于CH3COOH中c(H+),据此进行解答;
②溶液的导电能力与离子浓度成正比;
③酸抑制水电离,酸中氢离子浓度越大,其抑制程度越大;
④中和等物质的量的NaOH溶液,消耗酸的体积与酸的浓度成反比;
(2)根据醋酸的电离平衡CH3COOH ![]() CH3COO-+H+ 和电荷守恒来计算;
CH3COO-+H+ 和电荷守恒来计算;
(3)pH相等的醋酸和盐酸中,加水稀释促进醋酸电离,导致稀释相同的倍数时,醋酸的pH小于HCl;
(4)混合溶液呈中性,则c(H+)=c(OH-),醋酸钠是强碱弱酸盐,其溶液呈碱性,要使混合溶液呈中性,则醋酸应该稍微过量;
(5)25℃时,若向氨水中加入稀盐酸至溶液的pH=7,溶液呈中性说明氢离子和氢氧根的浓度一定相等,根据电荷守恒来判断离子浓度大小。
(1)① CH3COOH是弱电解质,HCl是强电解质,等浓度的两种溶液中盐酸中c(H+)大于CH3COOH中c(H+),所以醋酸的pH大于HCl,故①错误;
②CH3COOH是弱电解质,HCl是强电解质,等浓度的两种溶液中盐酸中离子浓度大于醋酸,溶液的导电能力与离子浓度成正比,所以HCl溶液的导电能力强,故②错误;
③酸抑制水电离,酸中氢离子浓度越大,其抑制程度越大,等浓度的两种酸中,HCl中氢离子浓度大于醋酸,所以由水电离出的c(OH-)醋酸大于盐酸,故③错误;
④中和等物质的量的NaOH溶液,消耗酸的体积与酸的浓度成反比,两种酸的物质的量浓度相等,所以需要酸的体积相等,故④正确;
因此,本题正确答案是:④。
(2)在 pH=5的稀醋酸溶液中, c(H+)=10-5mol/L,则c(OH-)=10-9mol/L,根据醋酸溶液中电荷守恒可以知道: c(H+)=c(OH-)+c(CH3COO-),可以看出 c(CH3COO-)= c(H+)- c(OH-)= 10-5-10-9mol/L;
因此,本题正确答案是: 10-9mol/L ,10-5-10-9mol/L。
(3)pH相等的醋酸和盐酸中,加水稀释促进醋酸电离,导致稀释相同的倍数时,醋酸的pH小于HCl,根据图象知,Ⅰ是HCl变化曲线,
因此,本题正确答案是:Ⅰ。
(4)醋酸溶液是弱酸,pH为3的醋酸溶液中,醋酸的浓度大于10-3mol/L, pH=11的NaOH溶液浓度等于10-3mol/L,最后溶液恰好呈中性,则氢氧化钠溶液的体积稍大些,即: Va<Vb;因此,本题正确答案是: <。
(5)混合溶液呈中性,则c(H+)=c(OH-),再根据电荷守恒c(NH4+)+c(H+)=c(OH-)+ c(Cl-)可以知道: c(NH4+)=c(Cl-)= amol/L;
因此,本题正确答案是: amol/L。


科目:高中化学 来源: 题型:
【题目】氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:

(1)氢氧燃料电池的能量转化主要形式是______,在导线中电子流动方向为___________(用a、b 表示)。
(2)负极反应式为________。
(3)电极表面镀铂粉的原因为___________________________。
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2![]()
![]() 2LIH
2LIH
Ⅱ.LiH+H2O==LiOH+H2↑
①反应Ⅰ中的还原剂是_____,反应Ⅱ中的氧化剂是_____。
②已知LiH固体密度为0.82g/cm3。用锂吸收224L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为________。
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为___________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应:X(g)+3Y(g)2Z(g),有关下列图像的说法正确的是

A. 依据图甲可判断正反应为放热反应
B. 在图乙中,虚线可表示升高温度
C. 若正反应的ΔH<0,图丙可表示降低温度使平衡向逆反应方向移动
D. 由图丁中气体平均相对分子质量随温度的变化情况,可推知正反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯酸乙酯(简称EA)在精细化T领域应用广泛,可由乙炔、一氧化碳和乙醇合成,该方法称为乙炔羰基化法。
(l)以NiBr2为催化剂,在一定条件下发生以下反应
NiBr2(l)+CO(g) ![]() Br2NiCO(l) △H1=+165.4kJ/mol;
Br2NiCO(l) △H1=+165.4kJ/mol;
Br2NiCO(l)+CH3CH2OH(l)+C2H2(g) ![]() NiBr2(l)+CH2=CHCOOC2H5(l) △H2=-385.6 kJ/mol;
NiBr2(l)+CH2=CHCOOC2H5(l) △H2=-385.6 kJ/mol;
Br2NiCO(l)+3CO(g) ![]() Ni(CO)4(l)+ Br2(l) △H3=-451.7kJ/mol;
Ni(CO)4(l)+ Br2(l) △H3=-451.7kJ/mol;
请写出乙炔羰基化法合成EA的热化学方程式____________因存在副反应,为提高EA的产率,应适当____(填“增大”或“减小”)一氧化碳与乙炔的物质的量之比。
(2)在一定条件下,向反应釜中加入的乙醇1.55mol、乙炔0.52mol、一氧化碳和催化剂进行反应,反应30min时,乙炔的转化率为59%,前30min乙炔的平均反应速率为____mol/min。欲使前期反应速率提高,应采取的措施是____。
(3)乙炔羰基化反应达到平衡时总压强为5.5Mp,乙炔的平衡转化率与温度的关系如图所示[其中n(乙炔):n(CO):(乙醇)=1:1:1)]

忽略副反应的影响计算该反应在图中M点的平衡常数Kp=__(用平衡分压代替平衡浓度计算,P分压=P总压×气体物质的量分数)。
(4)下图为EA产率与反应压强的关系,图中曲线呈现先升高后降低的变化趋势,其升高的原因是________

(5)可利用铁作电极、过硫酸铵[(NH4)2S2O8]作为引发剂,通过电化学方法利用EA制备聚丙烯酸乙酯。电解时,铁电极产生的Fe2+与溶液中的S2O82-发生氧化还原反应生成自由基SO4-·,引发聚合,形成聚丙烯酸乙酯。写出产生自由基SO4-·的离子方程式_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y两根金属棒插入Z溶液中构成如图所示装置,实验中电流表指针发生偏转,同时X棒变粗,Y棒变细,则X、Y、Z可能是下列中的( )

编号 | X | Y | Z |
A | Zn | Cu | 稀硫酸 |
B | Ag | Zn | 硝酸银溶液 |
C | Cu | Ag | 硫酸铜溶液 |
D | Cu | Zn | 稀硫酸 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)分别按如图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸。请回答下列问题:

①以下叙述中,正确的是__(填字母)。
A.甲中锌片是负极,乙中铜片是正极
B.两装置中铜片表面均有气泡产生
C.装置乙中存在“化学能→电能→光能”的转化
D.乙的外电路中电流方向Zn→Cu
E.如果将装置乙中锌片换成铁片,则电路中的电流方向不变
F.乙溶液中SO42-向铜片方向移动
②在乙实验中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是___。
③在乙实验中,如果把硫酸换成硫酸铜溶液,当负极材料消耗的质量为2.6g时,则电路中转移电子数为___。
(2)某种燃料电池的工作原理示意如图所示,a、b均为惰性电极。
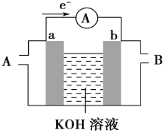
①电池工作时,空气从__口通入(填“A”或“B”);
②若使用的燃料为甲醇(CH3OH),a极的电极反应式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工厂生产的漂白粉,产品说明书如下:
漂白粉使用说明书
主要成分:次氯酸钙、氯化钙
用法用量:每次取漂白粉2 g,水1 000 mL,配成0.2%~0.3%的浊液。
将病人用具浸泡其中5~10分钟,如需要,浓度可提高,时间可延长。
注意事项:……
回答下列问题:
(1)请你为漂白粉写一份保存、使用的注意事项(不超过35字)_____。
(2)用化学方程式表示:
①漂白粉的生产原理:______________;
②一般情况下,漂白粉失效的主要原因:__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将尿酸钠(NaUr)悬浊液静置,取上层清液,再通入HCl,溶液中尿酸的浓度c(HUr)与pH 的关系如图所示。已知:Ksp(NaUr)=4.9×10-5,Ka(HUr)=2.0×10-6。下列说法正确的是
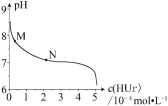
A. 上层清液中,c(Ur-) = 7.0×10-2mol·L-1
B. 在M→N 的变化过程中,c(Na+)·c(Ur-)将逐渐减小
C. 当c(HUr)= c(Ur-)时,c(Cl-)=c(Ur-)
D. 当pH=7时,2c(Na+)= c(Ur-)+c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气无害化处理反应为2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH<0。下列说法正确的是
N2(g)+2CO2(g) ΔH<0。下列说法正确的是
A. 升高温度可使该反应的正反应速率增大,逆反应速率减小
B. 增大压强,可以使NO和CO完全转为为无污染的N2和CO2,而消除污染
C. 该反应反应物总能量小于生成物总能量
D. 使用高效催化剂可降低反应的活化能,增大活化分子百分数,反应速率增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com