
分析下面氧化还原反应中化合价变化关系,用双线桥标出电子转移方向和数目,并在横线上回答指定问题。
(1) 2KMnO4+16HCl=2KCl+2MnCl2+5Cl2+8H2O (双线桥法表示2分)
氧化剂 ,还原剂 ,该反应中盐酸既表现 性,又表现 性。
(2)(2分)当有2. 5mol Cl2生成时,转移 mol电子
科目:高中化学 来源: 题型:阅读理解
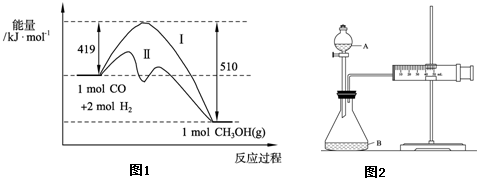
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 实验内容 | 实验操作 | 实验现象 | 推断生成物 |
| 氯气与铁反应 | |||
| 氯气与氢气反应 | |||
| 氯气与碘化钾溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| NO | - 4 |
| 测试时间/h | 0 | 1 | 2 | 3 | 4 | 6 | 6 |
| 样本的Ph | 4.93 | 4.72 | 4.63 | 4.58 | 4.56 | 4.55 | 4.55 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com