
【题目】周期表前四周期的元素X、Y、Z、T、W,原子序数依次增大。X的核外电子总数与其周期数相同,Y基态原子的p电子数比s电子数少1个,Z基态原子的价电子层中有2个未成对电子,T与Z同主族,W基态原子的M层全充满,N层只有一个电子。回答下列问题:
(1)Y、Z、T中单质熔点最高是______(填元素符号)
(2)比W原子序数少5的基态原子中单电子数为_________________。
(3)T与Z形成的化合物中,中心原子杂化类型是_______
(4)X和上述其他元素中的一种形成的化合物中:分子呈三角锥形的是________(填化学式);分子中既含有极性共价键,又含有非极性共价键的化合物是_______(填化学式,写一种)。
(5)这5种元素形成的一种阴阳离子个数比为1:1型的配合物中,阴离子呈四面体结构,阳离子的结构如图所示。该配合物的化学式为__________,阳离子中存在的化学键类型有_______。
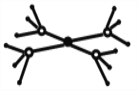
【答案】 S 6 sp2 NH3 H2O2或N2H4 [Cu(NH3)4]SO4 共价键、配位键或极性共价键、配位键
【解析】周期表前四周期的元素X、Y、Z、T、W,原子序数依次增大。X的核外电子总数与其周期数相同,则X为H元素;Y基态原子的p电子数比s电子数少1个,则核外电子排布为1s22s22p3,故Y为N元素;W基态原子的M层全充满,N层只有一个电子,则其核外电子数为2+8+18+1=29,故W为Cu;T与Z同主族,Z基态原子的价电子层中有2个未成对电子,外围电子排布ns2np2或ns2np4,由于Z原子序数大于氮,T的原子序数小于Cu,外围电子排布不能为ns2np2,只能为ns2np4,故Z为O元素、T为S元素。则
(1)氮气、氧气常温下均是气态,S是固体,则单质熔点最高是S;(2)比W原子序数少5的元素是Cr,其基态原子的核外电子排布式为1s22s22p63s23p63d54s1,所以单电子数为6。(3)S与O形成的化合物有SO2、SO3,中心原子杂化类型均是sp2;(4)X和上述其他元素中的一种形成的化合物中,分子呈三角锥形的是NH3;分子中既含有极性共价键,又含有非极性共价键的化合物是H2O2或N2H4。(5)这5种元素形成的一种阴阳离子个数比为1:1型的配合物中,阳离子的结构如图所示,配体中有3个共价键、1对孤对电子,为NH3,配离子为[Cu(NH3)4]2+,阴离子带2个单位负电荷,且呈四面体结构,为SO42-,故配合物化学式为:[Cu(NH3)4]SO4,阳离子中存在的化学键类型有:共价键、配位键。


科目:高中化学 来源: 题型:
【题目】下列措施对增大反应速率明显有效的是( )
A.Na与水反应时增大水的用量
B.Fe与稀硫酸反应制取氢气时,改用浓硫酸
C.在K2SO4与BaCl2两溶液反应时,增大压强
D.将铝片改为铝粉,做铝与氧气反应的实验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列流程图,回答有关问题:
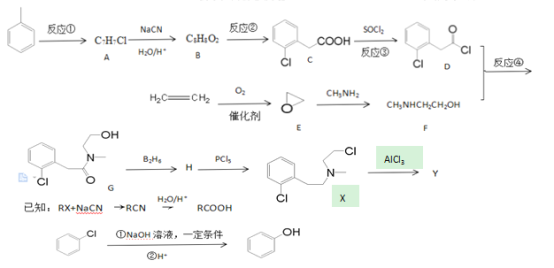
(1)写出化合物的结构简式:H____________
(2)下列说法正确的是:__________
A.反应①的试剂与条件为氯气、光照
B.化合物E是乙醛的同分异构体,能发生银镜反应
C.从乙烯到化合物F的转化过程中,涉及的反应类型有氧化反应、加成反应
D.X的分子式为C11H13NCl2
(3)反应④的方程式:__________________________________________________
(4)写出同时符合下列条件的C的所有同分异构体的结构简式:
____________________________________________________________________
①氢谱显示分子中有四种不同化学环境的氢,且苯环上的一溴代物只有两种
②可以发生银镜反应,能发生水解反应,水解产物之一能与FeCl3溶液发生显色反应
(5)设计以甲苯为原料生产水杨酸的合成路线。___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是几种有机化合物的转换关系:

请回答下列问题;
(1)根据系统命名法,化合物A的名称是____________________。
(2)反应①的反应类型是__________________,反应③的反应类型是_________________________。
(3)化合物E是重要的工业原料,写出由D→E的化学方程式:__________________________。
(4)C2的结构简式是_________________________,F1的结构简式是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,向xgKNO3不饱和溶液中,加入agKNO3或蒸发掉bg水恢复到t℃,溶液均达到饱和,据此下列推论错误的是
A. 在t℃时,KNO3的溶解度为100a/b g
B. 若原溶液中溶质质量分数为![]() ,则x=2b
,则x=2b
C. 若原不饱和溶液蒸发掉2b g水,恢复到原温度,能析出2a gKNO3
D. 在t℃时所配得的KNO3溶液中溶质质量分数≤![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组用如图所示装置测定锌铜合金中锌、铜的质量分数。
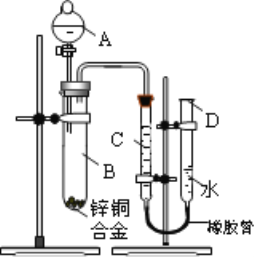
(1)实验前,先将锌铜合金在稀硫酸中浸泡片刻,其目的是:___________________________________;
(2)实验操作步骤有:①将药品和水装入各仪器中
②连接好装置后,检查气密性
③记录C的液面位置
④将B中剩余固体过滤,洗涤,干燥,称重
⑤待B中不再有气体产生并恢复至室温后,
记录C的液面位置
⑥由A向B滴加足量的稀硫酸
上述实验的正确操作顺序是________________(填序号);记录C的液面位置时,除视线平视外,还应_____________________
(3)B中发生反应的化学方程式为_________________ ;
(4)若实验用锌铜合金的质量为a g,与稀硫酸充分反应后,
B中剩余固体的质量为bg,则锌的质量分数为____________;
(5)实验过程中,若未洗涤过滤所得的不溶物,则测得锌的质量分数将______(填“偏大”“偏小”或“不受影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是一门以实验为基础的学科,下列操作或发生事故时的处理方法正确的是
A. 可用燃着的酒精灯引燃另一只酒精灯。
B. 给试管里的液体加热时,试管应与桌面垂直。
C. 配置一定浓度的NaCl溶液时,定容振荡摇匀后,发现液面低于刻度线,再加水到刻度线。
D. 浓硫酸不慎沾在皮肤上,应立即用大量水冲洗,最后涂上3%-5%的小苏打溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质用途的说法不正确的是( )
A. 明矾可用作净水剂 B. 二氧化硫可用于熏蒸粉丝
C. 碳酸氢钠可用于治疗胃酸过多 D. 镁铝合金可用于制金属门窗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列热化学方程式:
①C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ/mol
②H2(g)+![]() O2(g)===H2O(l) ΔH2=-285.8 kJ/mol
O2(g)===H2O(l) ΔH2=-285.8 kJ/mol
③CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH3=-870.3 kJ/mol
可以计算出2C(s)+2H2(g)+O2(g)===CH3COOH(l)的反应热为( )
A.ΔH=+244.1 kJ/mol B.ΔH=-488.3 kJ/mol
C.ΔH=-996.6 kJ/mol D.ΔH=+996.6 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com