
 =0.4mol������ͭԪ���غ���n��Cu��+2n��Cu2O��=n[Cu��OH��2]�����Է�Ӧ�����Һ��n[[Cu��NO3��2]=n[Cu��OH��2]=0.4mol���ʷ�Ӧ��������ʣ�࣬
=0.4mol������ͭԪ���غ���n��Cu��+2n��Cu2O��=n[Cu��OH��2]�����Է�Ӧ�����Һ��n[[Cu��NO3��2]=n[Cu��OH��2]=0.4mol���ʷ�Ӧ��������ʣ�࣬ =0.4mol������ͭԪ���غ���n��Cu��+2n��Cu2O��=n[Cu��OH��2]�����Է�Ӧ�����Һ��n[[Cu��NO3��2]=n[Cu��OH��2]=0.4mol���ʷ�Ӧ��������ʣ�࣬
=0.4mol������ͭԪ���غ���n��Cu��+2n��Cu2O��=n[Cu��OH��2]�����Է�Ӧ�����Һ��n[[Cu��NO3��2]=n[Cu��OH��2]=0.4mol���ʷ�Ӧ��������ʣ�࣬

 ���б�ˢ��ϵ�д�
���б�ˢ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
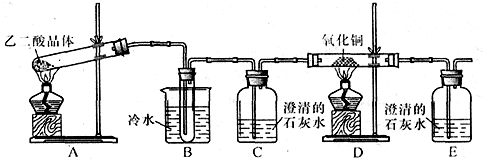
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����������ʵ���Ũ��Ϊ12.0mol/L | B�������������ڱ�״���µ����Ϊ13.44L | C��Cu��Cu2O �����ʵ���֮��Ϊ2��1 | D��Cu��Cu2O�����ᷴӦ��ʣ��HNO3Ϊ0.2mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ���Ϻ��г�����2013��߿�һģ��ѧ���� ���ͣ�022
|
��Cu��Cu2O�Ļ����27.2 g�м���ijŨ�ȵ�����0.1 L������������ȫ��Ӧ������NO2��N2O4��NO��Cu(NO3)2����������Һ�м���1.0 mol/L��NaOH��Һ1.0 L����Һǡ�ó����ԣ���������Ҳ����ȫ��������������Ϊ39.2 g���������ý��۲��������� | |
A�� |
��������ʵ���Ũ��Ϊ12.0 mol/L |
B�� |
�����������ڱ�״���µ����Ϊ13.44 L |
C�� |
Cu��Cu2O�����ʵ���֮��Ϊ2��1 |
D�� |
Cu��Cu2O�����ᷴӦ��ʣ��HNO3Ϊ0.2 mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ���Ϻ��г�����������ѧ����ĩ��ѧ�������л�ѧ�Ծ��������棩 ���ͣ�ѡ����
��Cu��Cu2O�Ļ����27.2g�м���ijŨ�ȵ�����0.1L������������ȫ��Ӧ������NO2�� N2O4��NO ��Cu��NO3)2 ����������Һ�м���1.0mol/L ��NaOH��Һ1.0L����Һǡ�ó����ԣ���������Ҳ����ȫ��������������Ϊ39.2g���������ý��۲���������
A����������ʵ���Ũ��Ϊ12.0mol/L
B�������������ڱ�״���µ����Ϊ13.44L
C. Cu��Cu2O �����ʵ���֮��Ϊ2:1
D. Cu��Cu2O�����ᷴӦ��ʣ��HNO3Ϊ0.2mol
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com