
【题目】现有金属单质A和气体甲、乙、丙及物质B、C、D、E、F、G,它们之间能发生如图反应(图中有些反应的产物和反应的条件没有全部标出).
请根据以上信息回答下列问题:
(1)实验室制取氯气的化学方程式为4HCl(浓)+MnO2 ![]() Cl2↑+MnCl2+2H2O,
Cl2↑+MnCl2+2H2O,
MnO2 做剂,如果反应产生的气体在标况下体积为2.24L,则被氧化的HCl的物质的量是mol
(2)写出下列反应的离子方程式:
①金属A和水
②物质B和气体乙
(3)用两个化学方程式表示固体G可做呼吸系统供氧剂原因
(4)用化学方程式解释F长期放置在空气中失效的原因:
(5)红热细铁丝能在气体乙剧烈燃烧,现象是将燃烧产物配成饱和溶液滴入沸水中可以得到的氢氧化铁胶体,该氢氧化铁胶体粒子直径在
之间.向氢氧化铁胶体中滴入过量稀硫酸,现象是 .
【答案】
(1)氧化,2
(2)2Na+2H2O=2Na++2OH﹣+H2↑,2OH﹣+Cl2=Cl﹣+ClO﹣+H2O
(3)2Na2O2+2CO2=2Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑
(4)Ca(ClO)2+H2O+CO2=CaCO3+2HClO、2HClO ![]() 2HCl+O2↑
2HCl+O2↑
(5)产生棕红色的烟,1﹣100nm,先产生红褐色沉淀最后溶解为黄色溶液
【解析】解:(1)反应中Mn元素化合价降低,被还原,则二氧化锰为氧化剂,如果反应产生的气体在标况下体积为2.24L,则生成1mol氯气,反应中Cl元素化合价由﹣1价升高到0价,则有2molHCl被氧化,
所以答案是:氧化; 2;
(2)①钠和水反应生成氢氧化钠和氢气,方程式为2Na+2H2O=2Na++2OH﹣+H2↑,
所以答案是:2Na+2H2O=2Na++2OH﹣+H2↑;
②氢氧化钠和氯气反应生成氯化钠、次氯酸钠和水,方程式为2OH﹣+Cl2=Cl﹣+ClO﹣+H2O,
所以答案是:2OH﹣+Cl2=Cl﹣+ClO﹣+H2O;
(3)过氧化钠可与水、二氧化碳反应生成氧气,可用作供氧剂,方程式为2Na2O2+2CO2=2Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑,
所以答案是:2Na2O2+2CO2=2Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑;
(4)漂白粉的主要成分为CaCl2、Ca(ClO)2,长期露置空气中时次氯酸钙与水、二氧化碳反应生成碳酸钙和HClO,HClO易分解,从而变质,发生变质时发生的反应为Ca(ClO)2+H2O+CO2=CaCO3+2HClO、2HClO ![]() 2HCl+O2↑,
2HCl+O2↑,
所以答案是:Ca(ClO)2+H2O+CO2=CaCO3+2HClO、2HClO ![]() 2HCl+O2↑;
2HCl+O2↑;
(5)铁在氯气中燃烧生成氯化铁,可观察到产生棕红色的烟,胶体粒子直径介于 1﹣100nm,在氢氧化铁胶体中加入盐酸,胶体发生聚沉,然后氢氧化铁溶液盐酸,可观察到先产生红褐色沉淀最后溶解为黄色溶液,
所以答案是:产生棕红色的烟;1﹣100nm; 先产生红褐色沉淀最后溶解为黄色溶液.


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,图为蒸馏实验装置.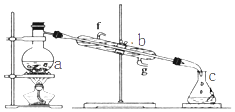
(1)写出下列仪器的名称:a. b.;
(2)若利用该装置分离四氯化碳和酒精的混合物,还缺少的仪器是 .
(3)某粗盐除含氯化钠外,还混有可溶性CaCl2、MgCl2、硫酸盐、泥砂等不溶性杂质,为提纯粗盐,可选用以下试剂及操作先后顺序可以是 (填选项字母)
①Na2CO3②NaOH ③BaCl2④HCl ⑤过滤 ⑥蒸发结晶,
A.②③①④⑤⑥
B.②③①⑤④⑥
C.②①③⑤④⑥
D.③②①⑤④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X是一种香料,可采用乙烯与甲苯为主要原料,按下列路线合成: 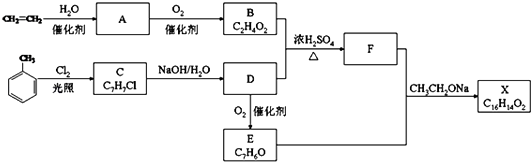
已知:RCHO+CH3COOR′ ![]() RCH=CHCOOR′请回答:
RCH=CHCOOR′请回答:
(1)A中官能团的名称是;C→D的反应类型为;
(2)B+D→F的化学方程式;
(3)E的结构简式;
(4)对于化合物X,下列说法正确的是;
A.能发生水解反应
B.能发生银镜反应
C.不与浓硝酸发生取代反应
D.能使Br2的CCl4溶液褪色
(5)F有多种同分异构体,含有酯基和一取代苯结构的同分异构体有五个,其中四个的结构简式是: ![]() CH2CH2OOCH、
CH2CH2OOCH、 ![]() COOCH2CH3、
COOCH2CH3、 ![]() CH2COOCH3、
CH2COOCH3、 ![]() 00CCH2CH3 . 请写出另外一个同分异构体的结构简式 .
00CCH2CH3 . 请写出另外一个同分异构体的结构简式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼及其化合物在工业上有许多用途.以铁硼矿(主要成分为Mg2B2O5H2O,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备硼酸(H3BO3)的工艺流程如图所示: 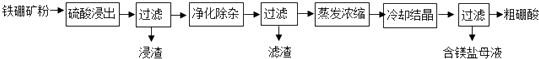
已知:Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、4.9、9.7和12.4.
回答下列问题:
(1)为提高“浸出”速率,除适当增加硫酸浓度外,还可采取的措施有;
(2)实验室中过滤操作所需要的玻璃仪器有:玻璃棒、;
(3)“浸渣”中的物质是(化学式);
(4)“净化除杂”需先加H2O2溶液,作用是 , 然后再调节溶液的pH约为5,目的是;
(5)“粗硼酸”中的主要杂质是(填名称);
(6)单质硼可用于生产具有优良抗冲击性能的硼钢.以硼酸和金属镁为原料在加热条件下可制备单质硼, 用化学方程式表示制备过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.加热鸡蛋、肉类,可使其中的蛋质变性
B.碳酸氢钠、氢氧化铝可用于治疗胃酸过多:
C.将海水中钢闸门连接电源负极可防止其被腐蚀
D.明矾[KAl(SO4)2·12H2O]用于净水是因为它有氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,氧化剂与还原剂化学计量数为1:2的是( )
A.Fe+2HCl═FeCl2+H2↑
B.2HCl+Ca(ClO)2═2HClO+CaCl2
C.I2+2NaClO3═2NaIO3+Cl2↑
D.4HCl(浓)+MnO2 ![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,烯烃可发生臭氧化还原水解反应,生成羰基化合物,该反应可表示为: 
![]()
 +
+  .
.
已知:
①化合物A,其分子式为C9H10O,它既能使溴的四氯化碳溶液褪色,又能与FeCl3溶液发生显色反应,且能与金属钠或氢氧化钠溶液反应生成B;
②B发生臭氧化还原水解反应生成C,C能发生银镜反应;
③C催化加氢生成D,D在浓硫酸存在下加热生成E;
④E既能使溴的四氯化碳溶液褪色,又能与FeCl3溶液发生显色反应,且能与氢氧化钠溶液反应生成F;
⑤F发生臭氧化还原水解反应生成G,G能发生银镜反应,遇酸转化为H(C7H6O2).
请根据上述信息,完成下列填空:
(1)写出下列化合物的结构简式(如有多组化合物符合题意,只要写出其中的一组) A , C , E .
(2)写出分子式为C7H6O2的含有苯环的所有同分异构体的结构简式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香化合物A、B互为同分异构体,B的结构筒式是 ![]() .A经①、②两步反应得C、D和E.B经①、②两步反应得E、F和H.上述反应过程、产物性质及相互关系如图所示. (提示:
.A经①、②两步反应得C、D和E.B经①、②两步反应得E、F和H.上述反应过程、产物性质及相互关系如图所示. (提示: 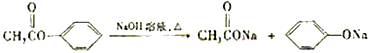 )
)
(1)写出E的结构简式 .
(2)A有2种可能的结构,写出相应的结构简式 .
(3)F和小粒金属钠反应的化学方程式是 , 实验现象是 , 反应类型是 .
(4)写出F在浓H2SO4作用下在170℃发生反应的化学方程式:实验现象是 , 反应类型是 .
(5)写出F与H在加热和浓H2SO4催化作用下发生反应的化学方程式 , 实验现象是 , 反应类型是 .
(6)在B、C、D、F、G、I化合物中,互为同系物的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究浓硫酸的性质,某同学进行如下实验:
(1)称取铁和碳固体混合物12.0g放入30.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y.取896mL(标准状况)气体Y通入足量溴水中,发生反应:
SO2+Br2+2H2O=2HBr+H2SO4然后加入足量BaCl2溶液,经适当操作后得到干燥固体4.66g.据此推知气体Y 中SO2的体积分数为 .
(2)分析上述实验中SO2体积分数的结果,该同学认为气体Y中还可能含有H2和CO2气体.为此设计了下列探究实验装置(图中夹持仪器省略).
①写出产生CO2的化学方程式 .
②装置A中试剂的作用是 , 装置B的作用是 .
③简述确认气体Y中含有CO2的实验现象 . 如果气体Y中含有H2 , 预计实验现象应是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com