
【题目】某温度下,在一容积固定的容器中,反应aA(g)+bB(g)![]() hH(g)达到平衡后,A、B、H的物质的量分别为amol、bmol和hmol。已知a+b=2h,若保持温度不变,将三者的物质的量增大一倍,则下列判断正确的是
hH(g)达到平衡后,A、B、H的物质的量分别为amol、bmol和hmol。已知a+b=2h,若保持温度不变,将三者的物质的量增大一倍,则下列判断正确的是
A.平衡不移动B.混合气体的密度不变
C.B的体积分数减少D.amol/L<c(A)<2amol/L
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】为探究某固体化合物X(仅含两种元素)的组成和性质,设计并完成如下实验,请回答:
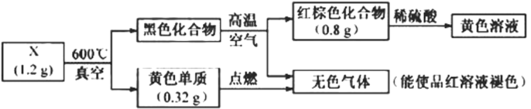
(1)X中的非金属元素是____,检验黄色溶液中的金属阳离子加入化学试剂是___。
(2)黑色化合物![]() 红棕色化合物的化学方程式是____。
红棕色化合物的化学方程式是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证同主族元素性质的递变规律。某小组用如图所示的装置进行实验(夹持仪器已略去,装置气密性已检验)。
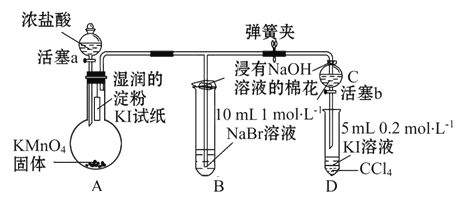
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当装置B和装置C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当装置B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
(1)浸有NaOH溶液的棉花的作用____________________________。
(2)装置A中发生的置换反应的化学方程式为___________________。
(3)装置B的溶液中NaBr完全被氧化,则消耗Cl2的物质的量为__________。
(4)为验证溴元素的非金属性强于碘元素,过程Ⅳ的操作和现象是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是工业上铝土矿(含有Al2O3和Fe2O3等)冶炼铝的工艺流程图:
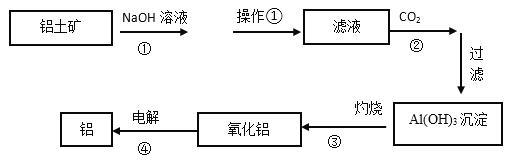
(1)操作①的名称是:_________。操作①剩余的矿渣主要成分为:__________(填化学式)。
(2)图中①的离子方程式___________________________;④的化学反应方程式___________。
(3)洗涤Al(OH)3沉淀的具体操作是: ________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对分子的性质的解释中,不正确的是

A. 水很稳定(1000℃以上才会部分分解),但与水中含有大量氢键无关
B. [Cu(NH3)4]SO4和(NH4)2SO4两种物质中都有配位键,所以都是配合物
C. 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释
D. 由如图知酸性:H3PO4>HClO,因为H3PO4的非羟基氧原子数大于次氯酸的非羟基氧原子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,在CO2低压合成甲醇反应(CO2+3H2=CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
(1)Co基态原子核外电子排布式为____。元素Mn与O中,电负性较大的是___,基态原子核外未成对电子数较多的是____。
(2)CO2和CH3OH分子中C原子的杂化形式分别为____和____。
(3)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为____。
(4)硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请阅读下列材料,完成下面小题。
汽车彻底改变了我们生活,成为我们的不可或缺的交通工具之一。汽车尾气系统中的催化转化器,可有效降低尾气中的CO、NO和NO2等向大气的排放,在催化转化器的前半部发生的反应为2CO(g)+2NO(g)![]() 2CO2(g)+N2(g)。
2CO2(g)+N2(g)。
【1】上述催化器中发生的反应属于
A.复分解反应B.分解反应C.置换反应D.不属于四种基本反应
【2】关于反应2CO(g)+2NO(g)![]() 2CO2(g)+N2(g)中,下列说法正确的是
2CO2(g)+N2(g)中,下列说法正确的是
A.CO作氧化剂B.CO发生氧化反应
C.NO被氧化D.NO作还原剂
【3】已知汽车尾气处理反应能量过程如下图,下列说法正确的是

A.该反应为放热反应
B.该反应为吸热反应
C.形成N≡N化学键需要吸收热量
D.反应物的总能量小于生成物的总能量
【4】下列反应条件的改变对该反应速率的影响正确的是
A.升高温度能减慢反应速率
B.增大反应物浓度能减缓反应速率
C.达到平衡时,CO能100%转化为CO2
D.使用催化剂能加快该反应的速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. HF酸的电离方程式可以表示为:HF+H2O![]() H3O++F—
H3O++F—
B. 加入铝粉可以释放出氢气的溶液中一定可以存在Na+、Cl—、NH4+、NO3—四种离子。
C. 由水电离出来的c(H+)=1×10—13mol·L—1的溶液中一定能存在CO32—、K+。
D. 向硫代硫酸钠中滴加稀硫酸的方程式为:3S2O32- + 2H+=4S↓+2SO42—+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸钾和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯。
(1) 请补充空白并配平化学方程式。
____KClO3+____HCl(浓) → ____KCl+____ClO2↑+____Cl2↑+ ___
(2) 浓盐酸在反应中显示出来的性质是________(填序号)
A. 只有还原性 B. 还原性和酸性 C.只有氧化性 D.氧化性和酸性
(3) 若反应中生成标准状况下13.44L气体,则消耗还原剂的物质的量为________。
(4) ClO2具有很强的氧化性,常用作消毒剂,其消毒的效率(以单位物质的量得到的电子数表示)是H2O2的______倍。
(5)过氧化钙也是一种优良消毒剂,供氧剂。通常情况下用CaCl2在稀氨水条件下与H2O2反应得到CaO2·8H2O沉淀,请写出该反应的化学方程式:___________________________________。
取2.76 g CaO2·8H2O样品受热脱水过程的热重曲线(140 ℃时完全脱水,杂质受热不分解)如图所示。
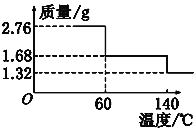
①试确定60 ℃时CaO2·xH2O中x=________。
②该样品中CaO2的质量分数为________。(保留一位小数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com