
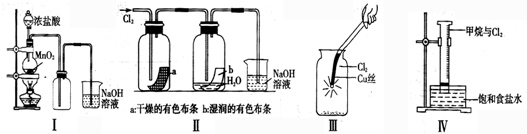
| A.Ⅰ图中:如果MnO2过量,浓盐酸就可全部消耗 |
| B.Ⅱ图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成 |
| C.Ⅲ图中:生成蓝色的烟 |
| D.Ⅳ图中:量筒中发生了加成反应 |


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:阅读理解
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:
A、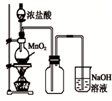 如图中:即使MnO2过量,盐酸也不能全部消耗 | B、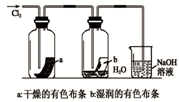 如图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成 | C、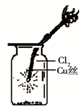 如图中:生成棕色的烟 | D、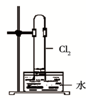 如图中:水可以充满试管 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验室制氯气中除去尾气用澄清石灰水 | B、吸收了氯气的NaOH溶液中滴入硫酸,至溶液显酸性,结果有Cl2生成 | C、铜丝在氯气中燃烧生成蓝色的烟 | D、甲烷和氯气的混合气体中发生了加成反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com