
【题目】Ⅰ.实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4,主要流程如下:
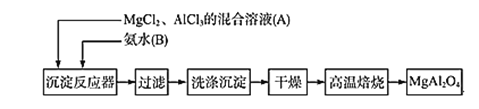
(1)写出AlCl3与氨水反应的化学反应方程式 _________________________________。
(2)判断流程中沉淀是否洗净的方法是__________________________________________,高温焙烧时,用于盛放固体的仪器名称是________________。
Ⅱ.无水AlCl3(183 ℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。
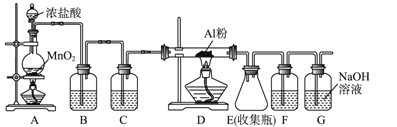
(3)其中装置A用来制备氯气,写出其化学反应方程式______________________。
(4)装置B中盛放饱和NaCl溶液,该装置的主要作用是_____________________。
(5)F中试剂是________。G为尾气处理装置,其中反应的离子方程式:____________________。
(6)制备氯气的反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:与足量AgNO3溶液反应,称量生成的AgCl质量。此方案_______(填“可行”,“不可行”),理由是__________________________________________。
【答案】AlCl3+3NH3·H2O===Al(OH)3↓+3NH4Cl 取最后一次洗涤液少量于试管中,滴加少量硝酸酸化的硝酸银,若没有白色沉淀产生,则证明沉淀已被洗涤干净 坩埚 MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 除去混在氯气中的氯化氢 浓硫酸 Cl2+2OH— = Cl—+ClO—+H2O 不可行 硝酸银不仅和过量的盐酸反应,也会和氯化锰反应生成沉淀
MnCl2+Cl2↑+2H2O 除去混在氯气中的氯化氢 浓硫酸 Cl2+2OH— = Cl—+ClO—+H2O 不可行 硝酸银不仅和过量的盐酸反应,也会和氯化锰反应生成沉淀
【解析】
本题是制备实验方案的设计。
(1)AlCl3与氨水反应生成氢氧化铝沉淀和氯化铵;
(2)判断流程中沉淀是否洗净的方法是取少量最后一次洗涤液,加入AgNO3溶液(或硝酸酸化的AgNO3溶液)溶液,若生成白色沉淀,则说明洗涤液中还含有Cl-,沉淀没有洗涤干净;若没有沉淀生成,则说明沉淀已经洗涤干净。
(3)根据实验装置图可知,该实验中用浓盐酸与二氧化锰反应生成氯气,氯气中有氯化氢、水等杂质,先用饱和食盐水除氯化氢,再用浓硫酸干燥,氯气与铝反应制得氯化铝,反应的尾气中有氯气用氢氧化钠吸收,为防止氯化铝与氢氧化钠溶液中的水蒸气反应,所以在收集装置和尾气吸收装置之间加一干燥装置F,据此分析解答。
Ⅰ.(1)AlCl3与氨水反应生成氢氧化铝沉淀和氯化铵,反应方程式为:AlCl3+3NH3·H2O===Al(OH)3↓+3NH4Cl。本小题答案为:AlCl3+3NH3·H2O===Al(OH)3↓+3NH4Cl。
(2)判断流程中沉淀是否洗净的方法是取少量最后一次洗涤液,加入AgNO3溶液(或硝酸酸化的AgNO3溶液)溶液,若生成白色沉淀,则说明洗涤液中还含有Cl-,沉淀没有洗涤干净;若没有沉淀生成,则说明沉淀已经洗涤干净。本小题答案为:取最后一次洗涤液少量于试管中,滴加少量硝酸酸化的硝酸银,若没有白色沉淀产生,则证明沉淀已被洗涤干净。
Ⅱ.(3)A中用浓盐酸与二氧化锰反应生成氯气,化学反应方程式为: MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。本小题答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O。本小题答案为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(4)氯气中混有氯化氢,氯化氢气体极易溶于水,装置B中盛放饱和NaCl溶液是用饱和NaCl溶液除去混在氯气中的氯化氢。本小题答案为:除去混在氯气中的氯化氢。
(5)为防止氯化铝与氢氧化钠溶液中的水蒸气反应,所以在收集装置和尾气吸收装置之间加一盛有浓硫酸的干燥装置F,G中用氢氧化钠处理未反应完的氯气,离子方程式为:Cl2+2OH-= Cl-+ClO-+H2O。本小题答案为:浓硫酸;Cl2+2OH- = Cl-+ClO-+H2O。
(6)A中还有盐酸与二氧化锰反应得到的氯化锰,硝酸银不仅和过量的盐酸反应,也会和氯化锰反应生成沉淀,故测定反应残余液中盐酸的浓度此法不可行。本小题答案为:不可行;硝酸银不仅和过量的盐酸反应,也会和氯化锰反应生成沉淀。


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】实验室欲用NaOH固体配制1.0 mol·L-1的NaOH溶液240 mL:
(1)配制溶液时,一般可以分为以下几个步骤:
①称量 ②计算 ③溶解 ④摇匀 ⑤转移 ⑥洗涤并转移
⑦定容 ⑧冷却 ⑨摇动
其正确的操作顺序为____________________。本实验必须用到的仪器有天平、药匙、玻璃棒、烧杯、______________。
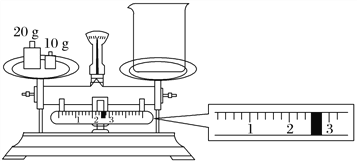
(2)某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图所示。烧杯的实际质量为________ g,要完成本实验该同学应称出________ g NaOH。
(3)使用容量瓶前必须进行的一步操作是____________________________________________。
(4)在配制过程中,其它操作都是正确的(按烧杯的实际质量),下列操作会引起误差偏低的是________。
A.转移溶液时不慎有少量洒到容量瓶外面
B.定容后塞上瓶塞反复倒转摇匀,静置后,液面低于刻度线,再加水至刻度线
C.称量时药品和砝码位置放反
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某100mL溶液可能含有Na+、NH4+、Fe3+、CO32﹣、SO42﹣、Cl﹣中的若干种,取该溶液进行连续实验,实验过程如图:(所加试剂均过量,气体全部逸出)下列说法不正确的是( )

A. 原溶液一定存在CO32﹣和SO42﹣,一定不存在Fe3+
B. 原溶液一定存在Cl﹣,可能存在Na+
C. 原溶液中c(Cl﹣)≥0.1molL﹣1
D. 若原溶液中不存在Na+,则c(Cl﹣)<0.1molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对金属制品进行搞腐蚀处理,可延长其使用寿命。
(1)以下为铝村表面处理的一种方法:
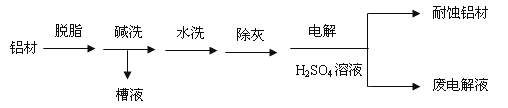
①碱洗的目的是除去铝村表面的自然氧化膜,碱洗衣时候常有气泡冒出,原因是:________(用离子方程式表示)。为将碱洗槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的__________。
a.NH3b.CO2c.NaOH d.HNO3
②以铝村为阳极,在H2SO4溶液中电解,铝村表面形成氧化膜,阳极电极反应式为:_____。
取少量废电解液,加入NaHCO3溶液后产生气泡和白色沉淀,产生沉淀的原因是_________。
(2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨做阳极的原因是 。
(3)利用下图装置,可以模拟铁的电化学防护。

若X为碳棒,为减缓铁的腐蚀,开关K应该置于 处。
若X为锌,开关K置于M处,该电化学防护法称为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,两圆圈相交的部分表示圆圈内的物质相互发生的反应。已知钠及其氧化物的物质的量均为0.1 mol,水的质量为100 g。下列说法正确的是( )

A. Na2O2中阴阳离子数目之比为1∶1
B. 反应①的离子方程式为Na+2H2O===Na++2OH-+H2↑
C. ①、②、③充分反应后所得溶液中溶质的质量分数:①>②>③
D. 反应③转移电子的物质的量为0.1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式表达正确的是(![]() 的绝对值均正确)
的绝对值均正确)
A. C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(g) △H=–1367.0 kJ/mol(燃烧热)
B. NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1) △H= +57.3kJ/mol(中和热)
C. S(s)+O2(g)=SO2(g) △H=–269.8kJ/mol (反应热)
D. 2NO2=O2+2NO △H= +116.2kJ/mol (反应热)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求写出下列反应的方程式:
(1)Al粉和NaOH溶液反应的化学方程式: _________________________________。
(2)漂白粉露置于空气中较长时间后失效的化学方程式: _________________________。
(3)铁粉和水蒸气反应化学方程式:_______________________________________。
(4)Cl2通入NaOH溶液中,发生反应的离子方程式:________________________。
(5)NaAlO2溶液中通入少量CO2,发生反应的离子方程式:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:将Cl2通入适量NaOH溶液中,产物中可能含有NaCl、NaClO、NaClO3,c(Cl-)/c(ClO-)的值与温度高低有关。当n(NaOH)=a mol时,下列说法不正确的是
A. 参加反应的氯气的物质的量等于(1/2)a mol
B. 改变温度,产物中NaC1O3的最大理论产量为(1/7)a mol
C. 改变温度,反应中转移电子的物质的量n(e-)的范围为(1/2)amol ≤ n(e-) ≤ (5/6)amol
D. 若某温度下,反应后c(Cl-)/c(ClO-)= 11,则溶液中c(ClO-)/c(ClO3-)= 1/2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应2A(g)+3B(g)![]() 3C(g),在一定条件下,使一定量A和B气体反应,达到平衡状态时,具有的关系是
3C(g),在一定条件下,使一定量A和B气体反应,达到平衡状态时,具有的关系是
A. 各物质的量浓度之比为c(A):c(B):c(C)=2:3:3
B. 平衡混合物体积是反应开始前的3/5
C. 平衡混合物中各物质的量浓度相等
D. 单位时间内,若消耗了a mol A物质,则同时也消耗了1.5a mol C物质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com