
| A. | 氧化剂与还原剂的物质的量之比为1:8 | |
| B. | 该过程说明Fe(NO3)2溶液不宜加酸酸化 | |
| C. | 若有1 mol NO3-发生氧化反应,则转移8 mol e- | |
| D. | Fe3+的氧化性比HNO3弱 |
分析 NO3-具有强氧化性,且氧化性:NO3->Fe3+,则反应中铁元素的化合价升高,N元素的化合价格下降低,应有8Fe2++NO3-+10H+=8Fe3++NH4++H2O,该反应说明Fe(NO3)2溶液不宜加酸酸化;该反应中氧化剂(NO3-)与还原剂(Fe2+)物质的量之比为1:8; 若有lmol NO3- 发生还原反应,转移电子数为8mol.
解答 解:发生反应的离子方程式为8Fe2++NO3-+10H+=8Fe3++NH4++H2O,则
A.反应中氧化剂(NO3-)与还原剂(Fe2+)物质的量之比为1:8,故A正确;
B.酸性条件下NO3-可氧化Fe2+,说明Fe(NO3)2溶液不宜加酸酸化,故B正确;
C.若有lmol NO3- 发生还原反应,转移电子数为8mol,而不是氧化,故C错误;
D.氧化还原反应中,氧化剂氧化性大于氧化产物的氧化性,则Fe3+的氧化性比HNO3弱,故D正确.
故选C.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及分析与应用能力的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 铁与稀硫酸反应 Fe+2H+═Fe3++H2↑ | |
| B. | 氯化铝溶液与氨水反应:Al3++3OH-═Al(OH)3↓ | |
| C. | 碳酸钙与稀盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| D. | 氢氧化铝与足量盐酸反应 Al(OH)3+3H+═Al3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 14g乙烯和丙烯的混合物中,含有共用电子对数目为3NA | |
| B. | 1mol苯酚中“C=C”的个数为3NA | |
| C. | 标准状况下,1L戊烷充分燃烧后生成的气态产物的分子数为$\frac{5}{22.4}$NA | |
| D. | 标准状况下,560mL甲烷和甲醛的混合气体中,含有的共用电子对数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在氮化铝的合成反应中,N2是还原剂,Al2O3氧化剂 | |
| B. | 上述反应中每生成2molAlN,N2得到3mol电子 | |
| C. | 氮化铝中氮元素的化合价为-3 | |
| D. | 氮化铝是铝合金中的一种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ||||
| 四 | ⑧ | ⑨ |
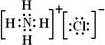 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.5 mol NO2与足量的H2O反应,转移的电子数为NA | |
| B. | 常温常压下,0.5NA个CO2分子质量为22 g | |
| C. | 28 g氮气所含的原子数目为NA | |
| D. | 在标准状况下,0.5NA个氯气分子所占体积是11.2 L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| A | 在常温、常压下,其单质是气体,随着人类对环境的认识和要求的提高,它将成为备受青睐的清洁燃料 |
| B | 工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障 |
| C | 植物生长三要素之一,它能形成多种氧化物,其中一种是早期医疗中使用的麻醉剂 |
| D | 室温下其单质为淡黄色粉末状固体,加热易熔化.该单质在氧气中燃烧,发出明亮的蓝紫色火焰 |
| E | 它在地壳中储量丰富,是人体不可缺少的微量元素之一.其单质为银白色固体,是工农业生产中不可或缺的金属材料,常用于机械制备、建筑等行业 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com