
 ���������dz��õ�ҽҩ�м��壬���ɱ����������Ʊ�����Ӧ�Ļ�ѧ����ʽ���£�
���������dz��õ�ҽҩ�м��壬���ɱ����������Ʊ�����Ӧ�Ļ�ѧ����ʽ���£�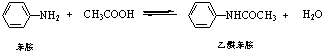
| ������ | �ܶȣ�g��cm-3�� | �ܽ��� | �۵㣨�棩 | �е㣨�棩 |
| ���� | 1.05 | ������ˮ���Ҵ� | 17 | 118 |
| ���� | 1.02 | ����ˮ���������Ҵ� | -6 | 184 |
| �������� | - | ������ˮ����������ˮ���������Ҵ� | 114 | 304 |
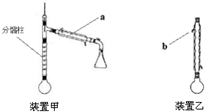
���� ��1������װ��ͼ��֪�������ƣ�����������ȴЧ�����жϣ�
��2����Բ����ƿ�м���5.0mL ������7.4mL���ᣬ���������ᷴӦ�ǰ�1��1��Ӧ��������������ܶȽӽ�����������������ݴ˴��⣻
��3���ᴿ�����еĵڢ۲�����Ŀ���ǽ�����̿��ȥ����ƷҪ������Һ�У�����Ҫ���ȹ��ˣ���ֹ����������ȴ����������ɲ�Ʒ��ʧ��
��4����������������ˮ����������ˮ���������Ҵ�������ϴ���Ǽ�Ҫ��ȥ���������ʣ���Ҫ��ֹ��Ʒ�ܽ����ɲ�Ʒ��ʧ��Na2CO3��Һ������NaCl��Һϴ���ֻ��������ʣ�
��5���������ַ�������ȡ���������������������������ʣ�����������Ӧ���������ɵ�ˮ�������ٽ���Ӧ��ʹ�üIJ��ʽϸߣ�
��� �⣺��1������װ��ͼ��֪����a�������������ܣ�����������ȴЧ���ÿ�֪b��ˮ�������dz�ˮ��
�ʴ�Ϊ�������ܣ���ˮ��
��2����Բ����ƿ�м���5.0mL ������7.4mL���ᣬ���������ᷴӦ�ǰ�1��1��Ӧ��������������ܶȽӽ����������������������Һ�е���Ҫ���������ᣬ
�ʴ�Ϊ�����
��3���ᴿ�����еĵڢ۲�����Ŀ���ǽ�����̿��ȥ����ƷҪ������Һ�У�����Ҫ���ȹ��ˣ���ֹ����������ȴ����������ɲ�Ʒ��ʧ��
�ʴ�Ϊ����ֹ�¶Ƚ��͵��������������������Ͳ��ʣ�
��4����������������ˮ����������ˮ���������Ҵ�������ϴ���Ǽ�Ҫ��ȥ���������ʣ���Ҫ��ֹ��Ʒ�ܽ����ɲ�Ʒ��ʧ��Na2CO3��Һ������NaCl��Һϴ���ֻ��������ʣ�����������ˮϴ�ӽϺ��ʣ���ѡA��
��5���������ַ�������ȡ���������������������������ʣ�����������Ӧ���������ɵ�ˮ�������ٽ���Ӧ��ʹ�üIJ��ʽϸߣ�
�ʴ�Ϊ�������������������Ӧ���������ɵ�ˮ�������ٽ���Ӧ��
���� ���⿼���л���ĺϳ�ʵ�顢����������ʵ�������Ŀ�����������۵ȣ��Ƕ�ѧ���ۺ������Ŀ��飬��Ҫѧ���߱���ʵ�Ļ������Ѷ��еȣ�


 �㽭��У��ʦ���ϵ�д�
�㽭��У��ʦ���ϵ�д� ȫ�ų��100��ϵ�д�
ȫ�ų��100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �¶ȣ��棩 | 0 | 20 | 60 |
| K2SO4�ܽ������g�� | 7.4 | 11.1 | 18.2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
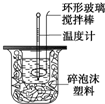 ������ͼװ�òⶨ�к��ȵ�ʵ�鲽�����£�
������ͼװ�òⶨ�к��ȵ�ʵ�鲽�����£�| �¶� ʵ������� | ��ʼ�� ��t1�� | ��ֹ�¶�t2/�� | �¶Ȳ�ƽ��ֵ��t2-t1��/�� | ||
| H2SO4 | NaOH | ƽ��ֵ | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | Cu2++2OH-=Cu��OH��2�� CuCO3+2NaOH�TCu��OH��2��+Na2CO3 | |
| B�� | CO32-+2H+=CO2��+H2O BaCO3+2HCl�TBaCl2+CO2��+H2O | |
| C�� | Ca2++CO32-=CaCO3�� Ca��NO3��2+Na2CO3�TCaCO3��+2NaNO3 | |
| D�� | H++OH-=H2O 2KOH+H2SO4�TK2SO4+2H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ڢۢ� | B�� | �����٢ۢ� | C�� | ����ʢڢ� | D�� | �ǵ���ʢܢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
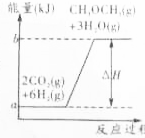 ����ҵ���ƶ���������һ���¶ȣ�230��280�棩��ѹǿ��2.0��10.0MPa���ʹ������ý��еģ���Ӧ���з��������з�Ӧ��
����ҵ���ƶ���������һ���¶ȣ�230��280�棩��ѹǿ��2.0��10.0MPa���ʹ������ý��еģ���Ӧ���з��������з�Ӧ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 8 | B�� | 10 | C�� | 12 | D�� | 14 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com