
3个氨基酸(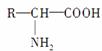 ,烃基R可以相同,也可以不同)分子失去2个水分子缩合成三肽。现有分子式为C36H57O18N11的十一肽完全水解成甘氨酸(C2H5O2N)、丙氨酸(C3H7O2N)、谷氨酸(C5H9O4N),在缩合十一肽化合物时,这3种氨基酸的物质的量之比为( )
,烃基R可以相同,也可以不同)分子失去2个水分子缩合成三肽。现有分子式为C36H57O18N11的十一肽完全水解成甘氨酸(C2H5O2N)、丙氨酸(C3H7O2N)、谷氨酸(C5H9O4N),在缩合十一肽化合物时,这3种氨基酸的物质的量之比为( )
A.3∶3∶5 B.3∶5∶3
C.5∶3∶3 D.8∶7∶7
科目:高中化学 来源: 题型:
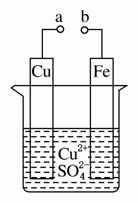
某小组为研究电化学原理,设计如图装置。下列叙述不正确的是( )
A.a和b不连接时,铁片上会有金属铜析出
B.a和b用导线连接时,铜片上发生的反应为Cu2++2e-===Cu
C.无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
D.a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸钠(Na2FeO4)是一种新型消毒剂,工业上制备高铁酸钠有下列四种方法:
a.2Fe(OH)3+3NaClO+4NaOH===2Na2FeO4+3NaCl+5H2O;
b.2FeSO4+6Na2O2===2Na2FeO4+2Na2O+2Na2SO4+O2↑;
c.Fe2O3+3Na2O2===2Na2FeO4+Na2O;
d.Fe(NO3)3+NaOH+Cl2―→Na2FeO4+NaNO3+NaCl+H2O。
请回答下列问题:
(1)下列判断正确的是________(填序号)。
A.方法a、b、c都可在水溶液中进行
B.根据a、b可知NaClO、Na2O2的氧化性均强于Na2FeO4的
C.FeSO4只有还原性,没有氧化性
D.能用KSCN溶液检验b的产物中是否含有FeSO4
(2)对于方法c下列说法正确的是________(填序号)。
A.Na2O2既是氧化剂又是还原剂
B.还原产物只有Na2O
C.3 mol Na2O2发生反应,有6 mol电子转移
D.在Na2FeO4中Fe为+4价,具有强氧化性,能消毒杀菌
(3)对于方法d,请回答下列问题:
①氧化剂与还原剂的物质的量之比为________。
②写出Na2FeO4与H2O反应的离子方程式:____________________________,
请你推测Na2FeO4除了能消毒杀菌外,另一个用途是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
有关天然产物水解的叙述不正确的是( )
A.油脂水解可得到丙三醇
B.可用碘检验淀粉水解是否完全
C.蛋白质水解的最终产物均为氨基酸
D.纤维素水解与淀粉水解得到的最终产物不同
查看答案和解析>>
科目:高中化学 来源: 题型:
玻璃器皿上沾有一些用水洗不掉的残留物,其洗涤方法正确的是( )
①残留在试管内壁上的碘,用酒精洗涤 ②盛放过苯酚的试剂瓶中残留的苯酚,用酒精洗涤 ③做银镜反应后试管壁上的银镜,用稀氨水洗涤 ④沾附在试管内壁上的油脂,用热碱液洗涤
A.①③④ B.②③④
C.①②④ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
科学家发现某药物M能治疗心血管疾病是因为它在人体内能释放出一种“信使分子”D,并阐明了D在人体内的作用原理。
请回答下列问题:
(1)已知M的相对分子质量为227,由C、H、O、N四种元素组成,C、H、N的质量分数依次为15.86%、2.20%和18.50%,则M的分子式是____________。D是双原子分子,相对分子质量为30,则D的分子式是______________________________。
(2)油脂A经如图所示的途径可得到M。



图中②的提示为:

反应①的化学方程式是
________________________________________________________________________;
反应②的化学方程式是
(3)C是B和乙酸在一定条件下反应生成的化合物,相对分子质量为134,写出C所有可能的结构简式: ________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应:2SO2(g)+O2(g)2SO3(g) ΔH<0。某温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是 ( )。
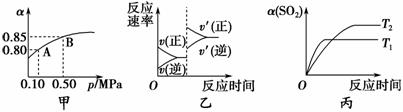
A.由图甲推断,B点SO2的平衡浓度为0.3 moL·L-1
B.由图甲推断,A点对应温度下的平衡常数为80
C.达到平衡后,缩小容器容积,则反应速率变化图像可以用图乙表示
D.压强为0.50 MPa时,不同温度下SO2的平衡转化率与温度关系如图丙,则T2>T1
查看答案和解析>>
科目:高中化学 来源: 题型:
化学反应过程中一定伴随着能量变化,某同学通过如下实验进行探究。
Ⅰ.探究化学反应中的能量变化。通过如下实验测出,烧杯中的温度降低。

(1)Ba(OH)2·8H2O跟NH4Cl的反应的化学方程式:
________________________________________________________________。
(2)从反应热的角度分析,该反应属于________(填“吸热”或“放热”)反应;从氧化还原角度分析,该反应属于
________(填“氧化还原”或“非氧化还原”)反应;从基本反应类型上分析,该反应属于________反应。
Ⅱ.测定稀硫酸和氢氧化钠溶液反应的中和热(实验装置如图所示)。

(1)图中尚缺少的一种仪器是________。
(2)实验时环形玻璃搅拌棒的运动方向是________。
a.上下运动 b.左右运动
c.顺时针运动 d.逆时针运动
(3)写出反应的热化学方程式为_______________________________________
________________________________________________________________________(中和热为57.3 kJ·mol-1)。
(4)该同学每次分别取0.50 mol·L-1 50 mL NaOH溶液和0.50 mol·L -130 mL硫酸进行实验,通过多次实验测定中和热ΔH= -53.5 kJ·mol-1,与57.3 kJ·mol-1有偏差,产生偏差的原因不可能是________(填字母)。
a.实验装置保温、隔热效果差
b.用量筒量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定硫酸溶液的温度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com