

| A.图l为某金属单质晶体中原子的堆积方式,则其晶胞构型为体心立方 |
| B.图2为钢闸门的防腐原理示意图,则钢闸门应与电源的正极相连 |
| C.图3表示CH3COOH溶液中加水时溶液的导电性变化,则CH3COOH溶液的pH:a>b |
| D.图4表示在容积相同的恒容密闭容器中,等量的N02在不同温度下反应: |
 N204(g),相同时间后测得N02含量的曲线,则该反应的△H<O
N204(g),相同时间后测得N02含量的曲线,则该反应的△H<O

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:单选题
| A.常温下,反应2A (s)+B (g)=2C (g)+D (g)不能自发进行,则该反应△H一定大于0 |
| B.铅蓄电池在放电过程中,负极质量增加,正极质量减少 |
| C.其他条件不变,向纯水中加入盐酸或氢氧化钠都能抑制水的电离,降低水的离子积 |
| D.常温下,向饱和碳酸钠溶液中加入过量碳酸钡粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,则常温下Ksp(BaCO3)<Ksp(BaSO4) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.SO2的催化氧化是一个放热的反应,升高温度,反应速率加快 |
| B.“冰,水为之,而寒于水”说明相同质量的水和冰,水的能量较高 |
C.A(g)+3B(g)  2C(g)达平衡后,恒温,增压,平衡正向移动,平衡常数K值增大 2C(g)达平衡后,恒温,增压,平衡正向移动,平衡常数K值增大 |
| D.在KI溶液中加入氯化银固体,沉淀变成黄色,说明同温度下Ksp(AgI)< Ksp(AgCl) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.平衡常数的大小与温度、浓度、压强、催化剂等有关 |
| B.当温度升高时,弱酸的电离平衡常数Ka变小 |
| C.KSP(AgCl) > KSP(AgI) ,由此可以判断AgCl(s) + I-(aq)= AgI(s)+ Cl-(aq)能够发生 |
| D.Ka(HCN) < Ka(CH3COOH) ,说明物质的量浓度相同时,氢氰酸的酸性比醋酸强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH(g) ⊿H
CH3OH(g) ⊿H| 化学键 | C—C | C—H | H—H | C—O | C≡O | H—O |
| 键能/kJ·mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
| 压强/MPa | 12.6 | 10.8 | 9.5 | 8.7 | 8.4 | 8.4 |
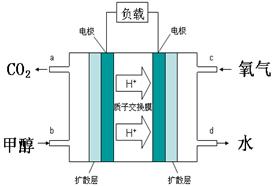
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO(g)+H2(g);ΔH= 。(用含ΔH1、ΔH2的代数式表示)
CO(g)+H2(g);ΔH= 。(用含ΔH1、ΔH2的代数式表示) CH3OH(g);ΔH3。现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1mol CO和2mol H2的混合气体,控温,进行实验测得相关数据如下图1和图2。
CH3OH(g);ΔH3。现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1mol CO和2mol H2的混合气体,控温,进行实验测得相关数据如下图1和图2。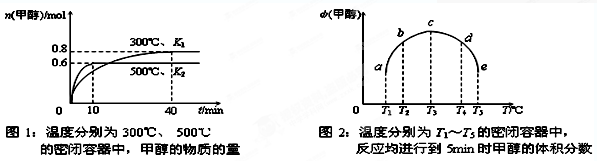
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.常温下pH相同的KOH溶液和K2CO3溶液中由水电离出的c(OH-) |
| B.浓度均为0.1mol·L-1的(NH4)2CO3溶液和(NH4)2SO4溶液中的c(NH4+) |
| C.3 L 0.1 mol·L-1CH3COOH溶液和1L 0.3 mol·L-1CH3COOH溶液中的H+离子数 |
| D.中和pH与体积均相同的NaOH溶液和氨水,所消耗H2SO4的物质的量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.测定中和反应的反应热时,大小两烧杯间填满碎纸的作用是固定小烧杯 |
| B.若用50mL 0.55mo1·L—1的氢氧化钠溶液,分别与50mL 0.50mo1·L—1的盐酸和50mL 0.50mo1·L—1的硫酸充分反应,两反应测定的中和反应的反应热不相等 |
| C.在中和滴定实验中,滴定管用蒸馏水洗涤后,然后用标准液润洗,再加进标准液 |
| D.进行中和滴定操作时,左手震荡锥形瓶,右手转动活塞控制液滴流速,眼睛要始终注视滴定管内溶液液面的变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com