
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
 N2O4,即生成的NO2又双聚成N2O4,导致气体分子数减少,使其压强略小于1.01×107Pa的
N2O4,即生成的NO2又双聚成N2O4,导致气体分子数减少,使其压强略小于1.01×107Pa的| 2 |
| 3 |
 N2O4,即生成的NO2又双聚成N2O4,导致气体分子数减少,使其压强略小于1.01×107Pa的
N2O4,即生成的NO2又双聚成N2O4,导致气体分子数减少,使其压强略小于1.01×107Pa的| 2 |
| 3 |


科目:高中化学 来源: 题型:
| A、水杨酸中毒应该静脉滴注碳酸钠溶液 | B、合成纤维、塑料、合成橡胶是常说的三大合成材料 | C、油脂是重要的体内能源,是人体不可缺少的营养物质 | D、以NaClO为有效成分的漂白液可以作为游泳池和环境的消毒剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、PM2.5(直径小于或等于2.5微米的颗粒物)它主要来自化石燃料的燃烧 | B、人体内的蛋白质不断分解,最终生成水和二氧化碳排出体外 | C、“地沟油”经过加工处理后,可以用来制肥皂和生物柴油 | D、电子垃圾的回收利用,可减少对土壤和水源的污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、自备购物布袋,不用塑料方便袋 | B、开发新能源,如太阳能、风能等,减少对化石能源的依赖 | C、推广煤的气化、液化技术,提供清洁燃料和化工原料 | D、给汽车安装尾气处理器 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2012年12月31日,山西一化工厂发生苯胺泄漏事故,苯胺对环境有污染 | B、纤维素、蔗糖、葡萄糖和脂肪在一定条件下都可以发生水解反应 | C、从海水中可以得到NaCl,电解熔融NaCl可制备Na | D、医疗上的血液透析利用了胶体的性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
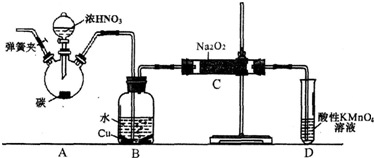
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、(CH3)2C=CH(CH2)2CH3 | B、CH2=CH(CH2)2CH3 | C、CH3CH=CH-CH=CH2 | D、CH3CH2CH=CHCH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、事物的性质总是在不断地发生变化 | B、元素周期表中最右上角的氦元素是得电子能力最强的元素 | C、ⅠA族元素的失电子能力肯 定比同周期ⅡA族元素的失电子能力强 | D、物质发生量变到一定程度必然引起质变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com