
| A. | 放电时,OH-向负极方向移动 | |
| B. | 放电时,正极反应式为Zn+2OH--2e-═ZnO+H2O | |
| C. | 充电时,Zn发生氧化反应 | |
| D. | 充电时,阴极附近PH 减小 |
分析 根据电池反应式Zn+Ag2O+H2O═Zn(OH)2+2Ag知,失电子的物质Zn作负极,得电子的物质Ag2O作正极,充电时为电解池,阴极的反应为负极的逆反应,阳极的反应为正极的逆反应,原电池放电时,电子从负极沿导线流向正极,根据电池电极附近氢离子或氢氧根离子浓度的变化判断溶液pH值的变化分析.
解答 解:A、放电时,阴离子向负极移动,则OH-向负极方向移动,故A正确;
B、氧化银作正极,正极的反应为Ag2O+2e-+H2O═2Ag+2OH-,故B错误;
C、充电时,阴极上Zn(OH)2得电子生成Zn,发生还原反应,故C错误;
D、充电时,阴极上Zn(OH)2得电子生成Zn,Zn(OH)2+2e-═Zn+2OH-,阴极附近溶液的pH升高,故D错误.
故选A.
点评 本题考查了原电池原理和电解池原理的应用,题目难度不大,明确电池正负极、阴阳极的判断方法、外电路中电子的流向、电极附近离子浓度的变化导致溶液pH值的变化即可解答本题.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②④⑥ | B. | ①②③⑤ | C. | ①③⑤⑥ | D. | ③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
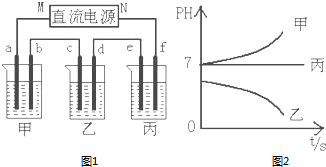 A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
A、B、C三种强电解质,它们在水中电离出的离子如下表所示:| 阳离子 | Ag+ Na+ |
| 阴离子 | NO3- SO42- Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
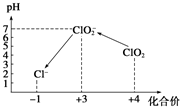 Cl2、ClO2等气体可作为水处理等方面有广泛应用的高效安全消毒剂.我国从2 000年起逐步用ClO2代替氯气对饮用水进行消毒.
Cl2、ClO2等气体可作为水处理等方面有广泛应用的高效安全消毒剂.我国从2 000年起逐步用ClO2代替氯气对饮用水进行消毒.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
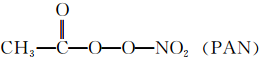 等二次污染物.
等二次污染物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,Mo3S4发生氧化反应 | |
| B. | 放电时,负极反应式:Mo3S4+2xe-→Mo3S42x- | |
| C. | 充电时,Mg2+向阴极迁移 | |
| D. | 充电时,阳极反应式:xMg2++2xe-→xMg |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 解释或结论 |
| A | 将蘸有浓硫酸的玻璃棒与蘸有浓氨水的玻璃棒靠近 | 无明显现象 | 氨气与硫酸不反应 |
| B | 用干净的铂丝蘸取某溶液,在酒精灯火焰上灼烧 | 透过蓝色钴玻璃片可以看到紫色的火焰 | 该溶液中有钾离子 |
| C | 在导管口点燃纯净的氢气,然后将导管伸入盛满氯气的集气瓶中 | 产生苍白色火焰 | 物质燃烧不一定需要氧气 |
| D | 加热试管中的氯化铵固体 | 试管底部的固体逐渐消失 | 氯化铵受热分解 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
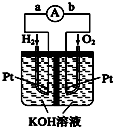 在能源日趋紧张的今天,科学工作者一直在研究如何提高现有化石能源的利用率,同时寻找开发清洁可再生能源.常采用的方法有煤的气化、煤的液化、设计燃料电池等.
在能源日趋紧张的今天,科学工作者一直在研究如何提高现有化石能源的利用率,同时寻找开发清洁可再生能源.常采用的方法有煤的气化、煤的液化、设计燃料电池等.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池工作时,锌失去电子,电解液内部OH-向负极移动 | |
| B. | 电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e-═Mn2O3(s)+2OH-(aq) | |
| C. | 电池工作时,电子由正极通过外电路流向负极 | |
| D. | 外电路中每通过0.2mol电子,锌的质量理论上减小6.5g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com