
| 实验操作 | 实验目的 | |
| A | 将卤代烃加入到热NaOH溶液中一段时间后,取上层液体,加入AgNO3液产生沉淀 | 证明卤代烃中含有卤元素 |
| B | 向丙烯醛(CH2=CH-CHO)中加入足量新制银氨溶液后,滴入KMnO4(H+)溶液,观察紫色褪去 | 证明结构中存在碳碳双键 |
| C | 淀粉在硫酸催化作用下水解,将新制氢氧化铜悬浊液加入到水解后的溶液中 | 检验淀粉水解的产物葡萄糖 |
| D | 向纯碱中滴加醋酸,将产生的气体先通入饱和碳酸氢钠溶液再通入苯酚钠浓溶液 | 证明酸性:醋酸>碳酸>苯酚 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.检验卤代烃水解产物,应先中和碱,再加硝酸银检验卤离子;
B.C=C、-CHO均能被KMnO4氧化;
C.应在碱性条件下反应;
D.醋酸易挥发.
解答 解:A.卤代烃中加入NaOH溶液,水解后,检验卤素离子应在酸性溶液中,则应先加硝酸至酸性,再加入AgNO3溶液检验,故A错误;
B.C=C、-CHO均能被KMnO4氧化,应排除-CHO的干扰,再滴入KMnO4(H+)溶液,观察紫色褪去,能证明结构中存在碳碳双键,故B错误;
C.淀粉在酸性条件下水解生成葡萄糖,葡萄糖与氢氧化铜浊液的反应应在碱性条件下进行,故C错误;
D.醋酸易挥发,能与苯酚钠反应,应先除去,故D正确.
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及离子检验、有机物的结构与性质及酸性比较等,把握物质的性质、反应原理为解答的关键,侧重分析与实验能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.1mol Fe与足量盐酸反应,转移的电子数为0.3NA | |
| B. | 0.1mol Na2SO4溶液中,含有SO42-数为0.1NA | |
| C. | 46gNO2和N2O4混合气体中,含有氧原子总数为3NA | |
| D. | 0.5L 1mol/LNaCl溶液中含有的钠离子浓度1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

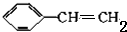 .
.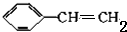 +HBr$\stackrel{一定条件下}{→}$
+HBr$\stackrel{一定条件下}{→}$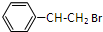 ;
;
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某课外兴趣小组对H2O2的分解速率做了如下实验探究.
某课外兴趣小组对H2O2的分解速率做了如下实验探究.| 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 | |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热 | 360 | 480 | 540 | 720 |
| MnO2催化剂、加热 | 10 | 25 | 60 | 120 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
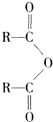 $\stackrel{H_{2}O}{→}$2RCOOH ②RCOOH$\stackrel{LiAlH_{4}}{→}$RCH2OH
$\stackrel{H_{2}O}{→}$2RCOOH ②RCOOH$\stackrel{LiAlH_{4}}{→}$RCH2OH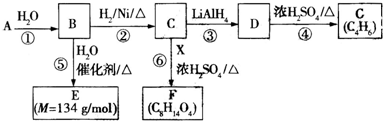
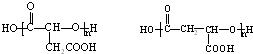 (一种即可).
(一种即可).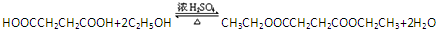 .
. .Y与足量氢氧化钠溶液反应所得产物之一M,能与灼热的氧化铜反应,写出M与灼热的氧化铜反应的化学方程式:
.Y与足量氢氧化钠溶液反应所得产物之一M,能与灼热的氧化铜反应,写出M与灼热的氧化铜反应的化学方程式: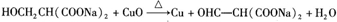 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
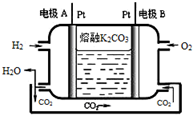 Ⅰ.短周期元素X、Y、Z、W在元素周期表中相对位置如图所示,其中Y所处的周期序数与族序数相等.按要求回答下列问题:
Ⅰ.短周期元素X、Y、Z、W在元素周期表中相对位置如图所示,其中Y所处的周期序数与族序数相等.按要求回答下列问题: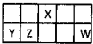
 .
.| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
NaHCO3溶液 BaCl2浓度 | 0.2mol•L-1 | 0.1mol•L-1 | 0.02mol•L-1 |
| 0.2mol•L-1 | 浑浊 | 浑浊 | 少许浑浊 |
| 0.1mol•L-1 | 浑浊 | 少许浑浊 | 无现象 |
| 0.02mol•L-1 | 少许浑浊 | 无现象 | 无现象 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com