
| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量a kJ |
| ② | 2 | 6 | 0 | 放出热量b kJ |
| ③ | 0 | 0 | 2 | 吸收热量c kJ |
| A、热量值关系一定满足:a=c<92.4 |
| B、三个容器内反应的平衡常数:③>①>② |
| C、达平衡时氨气的体积分数:①<② |
| D、N2的转化率:①>② |
| C2(NH3) |
| C(N2).C3(H2) |
| C(N2).C3(H2) |
| C2(NH3) |
| C2(NH3) |
| C(N2).C3(H2) |
| C(N2).C3(H2) |
| C2(NH3) |


 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源: 题型:
| A、遇苯酚变紫色的溶液:Na+、Mg2+、SO42-、Cl- |
| B、0.1 mol?L-1 (NH4)2Fe(SO4)2溶液中:K+、Cu2+、Cl-、MnO4- |
| C、使甲基橙变红色的溶液:NH4+、Cu2+、ClO-、Cl- |
| D、0.1mol?L-1 NaHCO3溶液:K+、AlO2-、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用聚氯乙烯塑料袋包装食品 |
| B、在食用盐中添加适量的碘酸钾 |
| C、在食品加工中科学使用食品添加剂 |
| D、研发高效低毒的农药,降低蔬菜的农药残留量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、通入乙烷的电极为正极 |
| B、参加反应的乙烷与氧气的物质的量之比为7:2 |
| C、负极反应式为C2H6+6H2O-→2CO32-+18H++14e- |
| D、放电一段时间后,KOH的物质的量浓度减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:

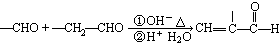

| NaCN |
| H+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
查看答案和解析>>
科目:高中化学 来源: 题型:
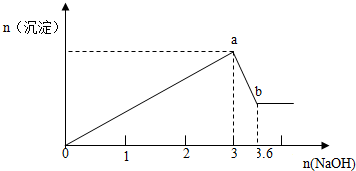
查看答案和解析>>
科目:高中化学 来源: 题型:
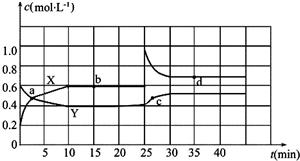
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com