
下列有关微粒性质的排序中,正确的是
A. 元素的非金属性:S>Cl>P>Si
B. 元素的原子半径:N < O < F
C. 离子半径:Al3+ > Mg2+ > Na+
D. 沸点:HCl < HBr < HF
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
 《物质结构与性质》
《物质结构与性质》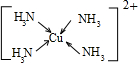

查看答案和解析>>
科目:高中化学 来源:2010年江苏省徐州市高三第三次调研考试(化学试题) 题型:填空题
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两
个选修模块的内容。请选择其中一题作答。若两题都做,则按A题评分。
A.微粒A、B、C为分子,D和F为阳离子,E为阴离子,它们都含有lO个电子;B溶
于A后所得的物质可电离出D和E;C是重要的化石能源。将A、B和含F离子的物
质混合后可得D和一种白色沉淀。 离子与Ar原子的电子层结构相同。请回答:
离子与Ar原子的电子层结构相同。请回答:
(1)基态G原子的外围电子排布式是 。在A、B、C这三种分子中,属于非极
性分子的有 (写化学式)。
(2)下列有关B的说法中正确的是 。(填字母)
a.在配合物中可作为配体 b.该分子的稳定性与氢键有关
c.分子由各原子最外层均为8 。的稳定结构
。的稳定结构
d.含1 mol B的液体中有3 mol氢键
(3)根据等电子体原理,D离子的空间构型是 ,其中心原子轨道的杂化类型
是 。
(4)构成C的中心原子可以形成多种单质,其中有一种为空间网状结
构,右图立方体中心的“●”表示该晶体中的一个原子,请在该
立方体的顶点上用“●”表示出与之紧邻的原子。
(5)光谱证实F与烧碱溶液反应有Na[F(OH)4]生成,则Na[F(OH)4]中
不存在 。(填字母)
a.金属键 b.离子键 c.非极性键 d.极性键
f.配位键 g. 键 h.
键 h. 键
键
B.对氨基苯磺酸是制取某些染料和药物的重要中间体,可由苯胺磺化得到:
实验室可用苯胺、浓硫酸为原料,利用右图所示实验装置合成。
实验步骤如下:
①取一个250mL的仪器a,加入10mL苯胺及几粒沸石,
放人冷水中冷却,小心地加入18 mL浓硫酸。再分别
装上冷凝管、温度计等。
②将a置于油浴中缓慢加热至170`180℃,维持此温度约2.5 h。
③将反应产物冷却至约50℃后,倒入盛有100  ,冷水的烧杯中,用玻璃棒不断搅拌,促使晶体析出。用该烧杯中的少量冷水将a内残留的产物冲洗到烧杯中,抽滤,用少量冷水洗涤,得到粗产品。
,冷水的烧杯中,用玻璃棒不断搅拌,促使晶体析出。用该烧杯中的少量冷水将a内残留的产物冲洗到烧杯中,抽滤,用少量冷水洗涤,得到粗产品。
④将粗产品用沸水溶解,冷却结晶(若溶液颜色过深,可用活性炭脱色),抽滤,收集
产品,晾干。(提示:100mL水在20℃时可溶解对氨基苯磺酸1.08 g,在100℃时可
溶解6.67 g)
(1)仪器a的名称是 。步骤①中加入沸石的作用是 。
(2)步骤②中采用油浴加热,下列说法正确的是 。(填字母)
A.便于控制温度 B.也可以改用水浴加热 C.温度计的水银球也可浸在油中
(3)步骤③用冷水洗涤的优点是 。
(4)步骤③和④均进行了抽滤操作,在抽滤完毕停止抽滤时,应注意先一二,然
后 。
(5)步骤④有时需重复进行多次,其目的是 。
查看答案和解析>>
科目:高中化学 来源:2013届辽宁省沈阳市第二十中学高三高考领航考试(三)化学试卷(带解析) 题型:填空题
【化学——选修物质结构与性质】(15分)第(6)题第一空为1分,其余为2分
用于合成氨的工业煤气中含有H2S、C2H5SH(乙硫醇)、COS(羰基硫)、CS2等含硫化合物,工业上无机硫常用氧化锌法处理,有机硫可用钴钼催化加氢处理。
H2S + ZnO ="=" ZnS + H2O; C2H5SH + ZnO ="=" ZnS + C2H4 + H2O;
C2H5SH + H2 ="=" C2H6 + H2S; COS + H2 ="=" CO + H2S; CS2 + 4H2 ="=" CH4+ 2H2S
(1)钴原子在基态时核外电子排布式为________________________。
(2)下列有关分子结构的说法正确的是_______________(填字母)。
A.C2H4分子中有5个σ键和1个π键
B.COS分子(结构如右图)中键能C=O>C=S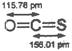
C.H2S分子呈V形结构 D.CH4、C2H6分子中碳原子均采用sp3杂化
(3)下列有关说法不正确的是____________________(填字母)。
A.H2O、CO、COS均是极性分子
B.相同压强下沸点:CS2>CO2
C.相同压强下沸点:C2H5SH>C2H5OH
D.相同压强下沸点:CO>N2
(4)β-ZnS的晶胞结构如右图,晶胞中S2-数目为_________个。S2的配位数是_______________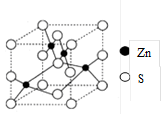
(5)具有相似晶胞结构的ZnS和ZnO,ZnS熔点为1830℃,ZnO熔点为1975℃,后者较前者高是由于_____________________________________________________________。
(6)钼的一种配合物化学式为:Na3[Mo(CN)8]?8H2O,中心原子的配位数为_____________________。写出与CN—的电性相同,结构相似的一种微粒的电子式_________________
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市杨浦区高三上学期期中考试化学试卷(解析版) 题型:填空题
四种短周期元素A、B、C、D的性质或结构信息如下。

信息① 原子半径大小:A>B>C>D
信息② 四种元素之间形成的某三种分子的比例模型及部分性质:
甲:是地球上最常见的物质之一,是包括人类在内所有生命生存的重要资源,也是生物体最重要的组成部分。
乙:无色,无味而易燃,是21世纪的主要能源。
丙:有强氧化性,可以用于消毒杀菌。请根据上述信息回答下列问题。
(1)丙 (写化学式)写出其分子的的电子式 。
(2)写出A原子最外层电子排布式 。将该元素的单质溶于水,形成的平衡体系中所有离子的浓度按由大到小排序:
(3)B形成的单质晶体可能为 。
A.离子晶体 B.分子晶体 C.原子晶体 D.金属晶体
(4)C的同主族元素的单质及其化合物的性质存在着相似性和递变性。下列有关说法正确的是____
A.其气态氢化物的稳定性按H2O、H2S、H2Se、H2Te的顺序依次减弱
B.其氢化物中的键长按O—H、S—H、Se—H、Te—H的顺序依次减小
C.其氢化物的沸点按H2O、H2S、H2Se、H2Te的顺序依次增强
D.其阴离子的还原性按O2–、S2–、Se2–、Te2–的顺序依次增强
(5)与氩原子质子数和电子数均相同的微粒有HCl、H2S、PH3、SiH4,以及还有_______ 、___________等(例举两种即可)
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省苏州市高三调研测试化学试卷(解析版) 题型:填空题
从原子、分子水平上帮助我们认识物质构成的规律;以微粒之间不同的作用力为线索,研究不同类型物质的有关性质;从物质结构决定性质的视角预测物质的有关性质。

(1)下列说法正确的是 (填序号)。
A.元素电负性由大到小的顺序为:F>O>N
B.一个苯分子含3个π键和6个σ键
C.氯化钠和氯化铯晶体中氯离子的配位数相同
D.第一电离能的大小为:Br>Se>As
(2)根据等电子体原理,羰基硫(OCS)分子的结构式应为 。光气(COC12)分子内各原子最外层都满足8电子稳定结构,则光气分子的空间构型为 (用文字描述)。
(3)Cu2+基态电子排布式为 。向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中会析出深蓝色的[Cu(NH3)4]SO4晶体,该物质中配位原子的杂化方式为 ,若不考虑空间构型,其内界结构可用示意图表示为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com