
【题目】NaHSO3可被过量KIO3氧化,当NaHSO3完全消耗时才有I2析出。某课题组用0.02mol/LNaHSO3溶液和0.02mol/L KIO3溶液,以及淀粉作指示剂,通过测定溶液变蓝所用时间来探究影响化学反应速率的因素。
(1)写出NaHSO3溶液与过量KIO3溶液反应生成I2的离子方程式:__________________________。
(2)调节反应物浓度和温度进行对比实验,记录结果如下:
编号 | NaHSO3溶液(mL) | KIO3溶液(mL) | H2O(mL) | 反应温度(℃)/ | 变蓝时间(t/s) |
① | 10 | 15 | a | 10 | t1 |
② | 10 | 40 | 0 | 10 | t2 |
③ | 10 | b | 0 | 20 | t3 |
表中a=_________,b=_________。
(3)改变反应温度,重复实验③,得到温度(T)与溶液变蓝所需时间(t)的关系如下图所示(“×××”表示超过50℃后溶液不会再变蓝)。

①在30℃下,若溶液变蓝时,I2的物质的量为n mol,则从反应开始至溶液变蓝,IO3-的平均反应速率为_______mol·L-1·s-1(写出表达式即可,不要化简)。
②根据图像,请你描述低于50℃时,溶液变蓝所需时间与反应温度的关系:__________________。
(4)将NaHSO3溶液与KIO3溶液混合(预先加入可溶性淀粉为指示剂),用速率检测仪检测出起始阶段反应速率逐渐增大,一段时间后反应速率又逐渐减小。课题组在排除浓度、温度等影响因素后,对起始阶段反应速率逐渐增大的原因提出如下假设,请你完成假设二:
假设一:反应生成的I2对反应起催化作用;I2浓度越大反应速率越快;
假设二:________________________________________________________;
假设三:________________________________________________________;
(5)请你设计实验验证上述假设一,完成下表中内容(反应速率可用测速仪测定)。
实验方案 | 预期实验现象和结论 |
第一步:在烧杯甲中将NaHSO3溶液与过量KIO3 溶液混合, 用测速仪测定起始时的反应速率V(甲) 第二步:在烧杯乙中________________________,测定其起始阶段的相同时间内的反应速率V(乙) | 若__________,则假 设一成立 |
【答案】 2IO3-+5HSO3-=5 SO42- +I2+3H++H2O 25 40 ![]() 温度低于30℃时,温度越高,溶液变蓝所需时间越短 温度高于30℃时,温度越高,溶液变蓝所需时间越长 反应生成的H+对反应起催化作用,H+浓度越大反应速率越快反应生成的SO42-对反应起催化作用,SO42- 浓度越大反应速率越快 在烧杯乙中进行同一反应(不同的是乙烧杯中预先加入少量I2,其他反应条件均完全相同) 若V(甲)< V(乙)则假设一成立
温度低于30℃时,温度越高,溶液变蓝所需时间越短 温度高于30℃时,温度越高,溶液变蓝所需时间越长 反应生成的H+对反应起催化作用,H+浓度越大反应速率越快反应生成的SO42-对反应起催化作用,SO42- 浓度越大反应速率越快 在烧杯乙中进行同一反应(不同的是乙烧杯中预先加入少量I2,其他反应条件均完全相同) 若V(甲)< V(乙)则假设一成立
【解析】试题分析:本题考查设计实验方案探究外界条件对化学反应速率的影响。
(1)NaHSO3溶液与过量KIO3溶液反应生成I2,KIO3被还原为I2,NaHSO3被氧化,可写出HSO3-+IO3-→SO42-+I2,根据得失电子守恒可配平5HSO3-+2IO3-→5SO42-+I2,结合原子守恒和电荷守恒得离子方程式为2IO3-+5HSO3-=5SO42- +I2+3H++H2O。
(2)通过比较分析,实验①和实验②反应温度相同,实验①和实验②是探究反应物KIO3浓度对化学反应速率的影响,10+15+a=10+40,a=25。实验②和实验③是探究温度对化学反应速率的影响,浓度必须相同,b=40。
(3)①根据图像在30℃下,从反应开始到溶液变蓝需要65s;若溶液变蓝时,I2的物质的量为n mol,根据I守恒,消耗的IO3-物质的量为2nmol,υ(IO3-)=2nmol![]() [(10+40)
[(10+40)![]() 10-3L]
10-3L] ![]() 65s=
65s=![]() mol·L-1·s-1。
mol·L-1·s-1。
②根据图像,低于50℃时,溶液变蓝所需时间与反应温度的关系:温度低于30℃时,温度越高,溶液变蓝所需时间越短;温度高于30℃时,温度越高,溶液变蓝所需时间越长。
(4)课题组排除了浓度、温度等影响因素,由于该反应中没有气体参与,所以对起始阶段反应速率逐渐增大的影响因素为催化剂,没有添加催化剂,所以起催化作用的应猜想为反应的生成物。假设一:反应生成的I2对反应起催化作用,I2浓度越大反应速率越快;假设二:反应生成的H+对反应起催化作用,H+浓度越大反应速率越快;假设三:反应生成的SO42-对反应起催化作用,SO42- 浓度越大反应速率越快。
(5)设计实验验证假设一,即设计实验方案验证I2的浓度对化学反应速率的影响。用控制变量法,乙中盛放与甲中相同的NaHSO3溶液与过量KIO3 溶液,只不过在乙中烧杯中预先加入少量I2,测定其起始阶段的相同时间内的反应速率V(乙)。若V(甲)![]() V(乙),则假设一成立。
V(乙),则假设一成立。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】实验室制氧气时,若取24.5g氯酸钾,与一定量二氧化锰共热,完全反应可生成氯化钾物质的量是多少?生成的氧气在标准状况下体积是多少?__________,__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. Na2O2用作呼吸面具的供氧剂B. NaHCO3的热稳定性大于Na2CO3
C. 乙醇可与金属钠反应放出氢气D. 钠久置在空气中最终产物为Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学技术名词审定委员会已确定第116号元素Lv的名称为鉝.关于 ![]() Lv的叙述错误的是( )
Lv的叙述错误的是( )
A.原子序数116
B.中子数177
C.核外电子数116
D.相对原子质量293
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关氯元素及其化合物的表示正确的是( )
A.质子数为17、中子数为20的氯原子: ![]() Cl
Cl
B.氯离子(Cl﹣)的结构示意图: 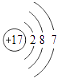
C.氯分子的电子式: ![]()
D.氯化氢的结构式:H﹣Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验事实所引出的相应结论正确的是
选项 | 实验事实 | 结论 |
A | 其他条件相同,Na2S2O3溶液浓度越大,析出硫沉淀所需时间越短 | 当其他条件不变时,增大反应物浓度化学反应速率加快 |
B | 在化学反应前后,催化剂的质量和化学性质都没有发生改变 | 催化剂一定不参加化学反应 |
C | H+浓度相同的盐酸和醋酸分别与等质量的形状相同的锌粒在不同环境下反应 | 反应开始时速率相同 |
D | 在容积可变的密闭容器中发生反应H2(g)+I2(g) | 正反应速率加快,逆反应速率不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016樟树市模拟】Fe2O3+3CO![]() 2Fe+3CO2 是炼铁高炉中发生的一个可逆反应.早在19世纪的欧洲,炼铁工程师就发现在其他条件不变时,增加高炉的高度,高炉尾气中CO的比例竟然没有改变.关于这一事实,下列说法不合理的是( )
2Fe+3CO2 是炼铁高炉中发生的一个可逆反应.早在19世纪的欧洲,炼铁工程师就发现在其他条件不变时,增加高炉的高度,高炉尾气中CO的比例竟然没有改变.关于这一事实,下列说法不合理的是( )
A.一定条件下,任何可逆反应的进程都有一定的限度,所以CO不可能完全转化
B.尾气中CO的比例不变,说明反应达到了这一条件下的化学平衡状态
C.尾气中CO的比例不变,是因为CO 的消耗速率与CO 生成速率相等
D.CO是气体,铁矿石(主要成分Fe2O3)是固体,CO 与铁矿石接触不充分
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com