
| A、将Ca(OH)2饱和溶液加热,溶液的pH增大 |
| B、常温下,pH=11的氨水与pH=3的盐酸等体积混合后,溶液的pH>7 |
| C、将0.1mol/L的HI溶液加水稀释l00倍,溶液中所有离子的浓度随之减小 |
| D、两种醋酸溶液的pH分别为a和(a+1),物质的量浓度分别为c1和c2,则有c1=10c2 |


科目:高中化学 来源: 题型:
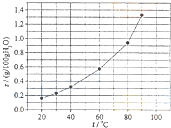
| A、溴酸银的溶解是放热过程 |
| B、温度升高时溴酸银溶解速度加快 |
| C、60℃时溴酸银的Ksp约等于6×10-4 |
| D、若硝酸钾中含有少量溴酸银,可用重结晶方法提纯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.8 mol |
| B、0.4 mol |
| C、0.2mol |
| D、0.6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe(OH)3胶体能够使水中悬浮的固体颗粒沉降,达到净水目的 |
| B、酸性氧化物都是非金属氧化物 |
| C、可利用焰色反应鉴别氯化钠和硫酸钾 |
| D、在水溶液中能电离出氢离子的物质为酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲中沉淀一定比乙中的多 |
| B、甲中沉淀可能比乙中的少 |
| C、甲中沉淀一定比乙中的少 |
| D、甲中和乙中的沉淀可能一样多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、④ | B、①② | C、①④ | D、①②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com