
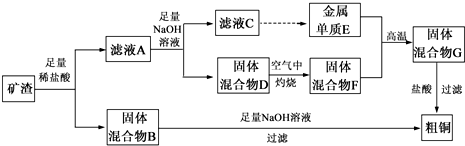
分析 工业矿渣中主要含有Cu2O,还有少部分Al2O3、Fe2O3、SiO2,加入足量的稀盐酸,Cu2O与盐酸反应生成Cu、CuCl2和水,Al2O3与盐酸反应生成AlCl3和水,Fe2O3与盐酸反应生成FeCl3和水,SiO2难溶于水,且不与水反应,生成的2FeCl3+Cu=2FeCl2+CuCl2,所以滤液A为CuCl2、AlCl3和FeCl2的混合物,得到的固体混合物B中有Cu和SiO2,固体混合物B与足量NaOH溶液混合,SiO2和NaOH溶液反应生成Na2SiO3和水,Cu与NaOH溶液不反应,得到粗铜,滤液A与足量NaOH溶液反应,CuCl2与NaOH反应生成Cu(OH)2 和水,FeCl2与NaOH溶液反应生成Fe(OH)2 白色沉淀,该沉淀在空气中与氧气反应生成Fe(OH)3,AlCl3与过量NaOH溶液反应生成NaAlO2和水,滤液C为NaAlO2溶液,经过一系列反应得到金属Al,固体混合物D为Cu(OH)2和Fe(OH)3,在空气中灼烧,Cu(OH)2和Fe(OH)3受热分解生成Fe2O3和CuO,所以固体混合物F为Fe2O3和Cu的混合物,该混合物与Al发生铝热反应,生成Fe和Cu,固体混合物G为Fe和Cu,与盐酸混合,Fe与盐酸反应生成FeCl2和氢气,Cu与盐酸不反应,过滤成为粗铜,据此分析解答.
解答 解:工业矿渣中主要含有Cu2O,还有少部分Al2O3、Fe2O3、SiO2,加入足量的稀盐酸,Cu2O与盐酸反应生成Cu、CuCl2和水,Al2O3与盐酸反应生成AlCl3和水,Fe2O3与盐酸反应生成FeCl3和水,SiO2难溶于水,且不与水反应,生成的2FeCl3+Cu=2FeCl2+CuCl2,所以滤液A为CuCl2、AlCl3和FeCl2的混合物,得到的固体混合物B中有Cu和SiO2,固体混合物B与足量NaOH溶液混合,SiO2和NaOH溶液反应生成Na2SiO3和水,Cu与NaOH溶液不反应,得到粗铜,滤液A与足量NaOH溶液反应,CuCl2与NaOH反应生成Cu(OH)2 和水,FeCl2与NaOH溶液反应生成Fe(OH)2 白色沉淀,该沉淀在空气中与氧气反应生成Fe(OH)3,AlCl3与过量NaOH溶液反应生成NaAlO2和水,滤液C为NaAlO2溶液,经过一系列反应得到金属Al,固体混合物D为Cu(OH)2和Fe(OH)3,在空气中灼烧,Cu(OH)2和Fe(OH)3受热分解生成Fe2O3和CuO,所以固体混合物F为Fe2O3和Cu的混合物,该混合物与Al发生铝热反应,生成Fe和Cu,固体混合物G为Fe和Cu,与盐酸混合,Fe与盐酸反应生成FeCl2和氢气,Cu与盐酸不反应,过滤成为粗铜,
(1)固体混合物B与氢氧化钠溶液反应的化学方程式为SiO2+2NaOH═Na2SiO3+H2O,SiO2 的重要用途为作光导纤维或压电材料或光学仪器等,
故答案为:SiO2+2NaOH═Na2SiO3+H2O;作光导纤维(或压电材料;或光学仪器等);
(2)滤液A中铁元素的存在形式只能为Fe2+,理由是Fe2O3与盐酸反应后生成的Fe3+与过量铜单质反应后,全部转化为Fe2+,涉及的离子方程式为Fe2O3+6H+═2Fe3++3H2O; Cu+2Fe3+═Cu2++2Fe2+;检验滤液A中Fe2+的方法是取少量溶液于试管中,加入硫氰化钾溶液,无现象,在加热新制氯水,溶液变成血红色,则滤液中含有Fe2+,所以试剂为硫氰化钾溶液和新制氯水,
故答案为:Fe2O3与盐酸反应后生成的Fe3+与过量铜单质反应后,全部转化为Fe2+;Fe2O3+6H+═2Fe3++3H2O; Cu+2Fe3+═Cu2++2Fe2+;硫氰化钾溶液和新制氯水;
(3)氢氧化铝溶于强酸和强碱,所以将可溶性铝盐中的铝元素以沉淀形式析出,需加入弱酸,选D,铝热反应用途之一是焊接钢轨,所以反应的化学方程为2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,
故答案为:D;2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3.
点评 本题考查物质分离和提纯及物质制备,为高频考点,侧重考查学生分析推断及知识综合应用能力,明确流程图中各物质成分及发生的反应、基本操作是解本题关键,熟练掌握常见离子、物质性质,知道铁离子、亚铁离子的检验方法,题目难度中等.


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠溶液盛装在用玻璃塞的试剂瓶中 | |
| B. | 氢氟酸盛装在塑料瓶中 | |
| C. | 硝酸银固体存放在棕色细口瓶中 | |
| D. | 金属锂、钠、钾均可保存在煤油中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 实验Ⅰ:液体分层,下层呈无色 | |
| B. | 实验Ⅱ:烧杯中先出现白色沉淀,后溶解 | |
| C. | 实验Ⅲ:试管中溶液颜色先变为灰绿色后迅速变为红色 | |
| D. | 实验Ⅳ:放置一段时间后,饱和CuSO4溶液中出现蓝色晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
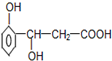 某有机物的结构简式如图所示,它可以发生反应的类型有( )
某有机物的结构简式如图所示,它可以发生反应的类型有( )| A. | ①②③④ | B. | ①②④⑤ | C. | ①②⑤⑥ | D. | ③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C5H12的烷烃,含有3个甲基结构的同分异构体有2种 | |
| B. | 乙烷、乙醇、乙酸、苯、纤维素、油脂、蛋白质均能发生取代反应 | |
| C. | 甲烷、苯都属于烃,都不存在同分异构体 | |
| D. | 相同质量的甲烷和乙烷完全燃烧,乙烷耗氧量多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 60mL | B. | 45mL | C. | 30mL | D. | 15mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com