
pH=13的 强碱与pH=1的强酸溶液等体积混合,所得混合液的pH值为( )
|
| A. | >7 | B. | <7 | C. | =7 | D. | 无法确定 |
考点:
pH的简单计算.
专题:
电离平衡与溶液的pH专题.
分析:
强酸和强碱在溶液中完全电离,pH=1的强酸溶液中c(H+)=0.1mol/L,但pH=13的强碱溶液中,氢氧根离子浓度为:c(OH﹣)=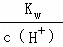 ,由于没有告诉温度,无法计算氢氧根离子浓度,则无法判断混合液的酸碱性.
,由于没有告诉温度,无法计算氢氧根离子浓度,则无法判断混合液的酸碱性.
解答:
解:pH=1的强酸溶液中氢离子浓度为:c(H+)=0.1mol/L,而没有告诉温度,无法计算pH=13的强碱溶液中氢氧根离子的浓度,
所以两溶液等体积混合后,无法计算混合液的pH,
故选D.
点评:
本题考查了酸碱混合的定性判断、溶液pH的简单计算,题目难度不大,注意掌握溶液酸碱性与溶液pH的关系,本题中需要明确温度对水的离子积的影响,为易错点.


科目:高中化学 来源: 题型:
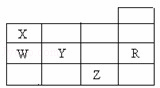
右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
|
| A. | 常压下五种元素的单质中,Z单质的沸点最高 |
|
| B. | Y、Z的阴离子电子层结构都与R原子的相同 |
|
| C. | W的氢化物的沸点比X的氢化物的沸点高 |
|
| D. | Y元素的非金属性比W元素的非金属性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
1.00L 1.00mol•L﹣1 NaOH溶液与足量的稀盐酸反应,放出 57.4kJ的热量.表示该反应的中和热的热化学方程式正确的是( )
|
| A. | NaOH+HCl═NaCl+H2O△H=+57.4kJ•mol﹣1 |
|
| B. | NaOH+HCl═NaCl+H2O△H=﹣57.4 kJ•mol﹣1 |
|
| C. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=+57.4 kJ•mol﹣1 |
|
| D. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=﹣57.4 kJ•mol﹣1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,发生CO+NO2⇌CO2+NO的反应,达到化学平衡后,降低温度,混合物的颜色变浅,下列有关该反应的说法中正确的是( )
|
| A. | 正反应为吸热反应 | B. | 正反应为放热反应 |
|
| C. | 降温后CO的浓度增大 | D. | 降温后各物质的浓度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
14CO2与碳在高温条件下发生反应:14CO2+C⇌2CO,达到平衡后,平衡混合物中含14C的粒子有( )
|
| A. | 14CO2 | B. | 14CO2、14CO |
|
| C. | 14CO2、14CO、14C | D. | 14CO |
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g)⇌Z(g)+W(s)△H>0.下列叙述正确的是( )
|
| A. | 加入少量W,逆反应速率增大 |
|
| B. | 当容器中气体压强不变时,反应达到平衡 |
|
| C. | 升高温度,平衡逆向移动 |
|
| D. | 平衡后加入X,上述反应的△H增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com