
| A. | 在原电池的负极和电解池的阴极上都发生失电子的氧化反应 | |
| B. | 用惰性电极电解饱和NaCl溶液,若有0.1 mol电子转移,则生成0.1 mol NaOH | |
| C. | 用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2 | |
| D. | 镀层破损后,镀锌铁板比镀锡铁板更易腐蚀 |
分析 A、阴极上得电子发生还原反应;
B、惰性电极电解饱和NaCl溶液,阳极氯离子失电子生成氯气,阴极是氢离子得到电子生成氢气,依据电极反应电子守恒计算分析;
C、惰性电极电解Na2SO4溶液,阳极是氢氧根离子失电子生成氧气,阴极是氢离子得到电子生成氢气;
D、铁比锡活泼,形成原电池时Fe为负极.
解答 解:A、原电池中,负极失电子发生氧化反应,电解池中阴极上得电子发生还原反应,故A错误;
B、惰性电极电解饱和NaCl溶液,阳极氯离子失电子生成氯气,阴极是氢离子得到电子生成氢气,依据电极反应电子守恒计算2H++2e-=H2↑,若有0.1mol电子转移,氢离子减小0.1mol,溶液中氢氧根离子增加0.1mol,则生成0.1mol NaOH,故B正确;
C、惰性电极电解Na2SO4溶液,实质是电解水,阳极是氢氧根离子失电子生成氧气,阴极是氢离子得到电子生成氢气,阴阳两极产物的物质的量之比为2:1,故C错误;
D、铁比锡活泼,形成原电池时Fe为负极失电子,所以镀层破损后,镀锡铁板比镀锌铁板更易被腐蚀,故D错误;
故选B.
点评 本题考查了原电池、电解池原理的分析应用,主要是电解名称、电极反应和电极产物的分析判断,掌握原理是关键,题目较简单.


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| Na2O | NaCl | AlF3 | AlCl3 |
| 920 | 801 | 1291 | 190 |
| BCl3 | Al2O3 | CO2 | SiO2 |
| -107 | 2073 | -57 | 1723 |
| A. | 铝的化合物的晶体中有的是离子晶体 | |
| B. | 表中只有 BCl3 和CO2是分子晶体 | |
| C. | 同族元素的氧化物只能形成同类型的晶体 | |
| D. | 不同族元素的氧化物不能形成相同类型晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图是两个反应的反应前后反应物总能量和生成物总能量的比较图,对于Ⅰ、Ⅱ两个反应的说法正确的是( )
如图是两个反应的反应前后反应物总能量和生成物总能量的比较图,对于Ⅰ、Ⅱ两个反应的说法正确的是( )| A. | 反应Ⅰ是放热反应,反应Ⅱ也是放热反应 | |
| B. | 反应Ⅰ是放热反应,反应Ⅱ是吸热反应 | |
| C. | 反应Ⅰ是吸热反应,反应Ⅱ也是吸热反应 | |
| D. | 反应Ⅰ不需要加热,反应Ⅱ必须加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20℃,4 mL硫酸,6 mL水 | B. | 20℃,5 mL硫酸,5 mL水 | ||
| C. | 30℃,5 mL硫酸,5 mL水 | D. | 30℃,4 mL硫酸,6 mL水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作 | 实验现象 | 实验结论 | |
| A | 碳酸钠粉末中加入适量醋酸 | 产生无色无味的气体 | 醋酸的酸性比碳酸强 |
| B | 乙烯通入酸性高锰酸钾溶液中 | 溶液褪色 | 乙烯能被高锰酸钾氧化 |
| C | 点燃苯 | 火焰明亮,并带有浓烟 | 苯的含碳量高 |
| D | 石蕊溶液中滴入乙酸 | 石蕊溶液变红色 | 乙酸是强酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某化合物在熔融态能导电,则该物质中一定含有离子键,可能含有共价键 | |
| B. | 冰是分子晶体,受热分解的过程中,只需克服分子间的作用力 | |
| C. | 某纯净物在常温下为气体,则组成该物质的微粒一定含有共价键 | |
| D. | 化学变化中往往伴随着化学键的破坏与形成,物理变化中一定没有化学键的破坏或形成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.15mol/L | B. | 0.3mol/L | C. | 0.225mol/L | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
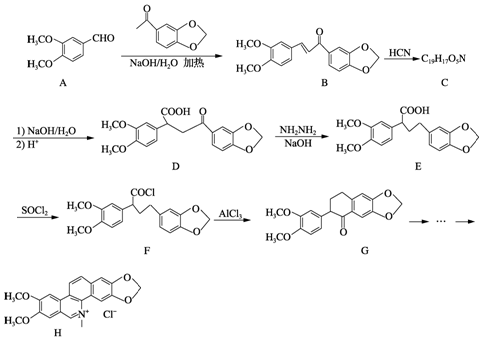
 ;由E→F的反应类型为取代.
;由E→F的反应类型为取代. .
. ,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干).
,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com