
| A.水分子的化学性质发生改变 | B.水的物理性质改变 |
| C.水分子间以共价键缔合 | D.水分子中氢氧键长缩短 |
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:判断题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
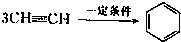 三聚氰胺也可以由氰胺(WXY分子中的W原子被氨基取代后可得氰胺)发生类似于乙炔的三聚反应而得到,三聚氰胺中无非极性键,含有量个氨基.请写出三聚氰胺结构简式:______.
三聚氰胺也可以由氰胺(WXY分子中的W原子被氨基取代后可得氰胺)发生类似于乙炔的三聚反应而得到,三聚氰胺中无非极性键,含有量个氨基.请写出三聚氰胺结构简式:______.
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 、L、M五种元素的原子序数依次增大。X、Y是组成有机物的基本元素,Z的最外层电子分布情况是P轨道上的电子比S轨道上的电子多一个,L在所有元素中电负性排第二位,其原子最外层有两个未成对电子,M的正三价离子其核外第三电子层有五个未成对电子。回答下列问题:
、L、M五种元素的原子序数依次增大。X、Y是组成有机物的基本元素,Z的最外层电子分布情况是P轨道上的电子比S轨道上的电子多一个,L在所有元素中电负性排第二位,其原子最外层有两个未成对电子,M的正三价离子其核外第三电子层有五个未成对电子。回答下列问题:查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.分子中 N-Cl键是非极性键 | B.分子中不存在孤对电子 |
| C.三氯化氮分子结构呈三角锥形 | D.因N-Cl 键键能大,它的沸点高 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.从CH4、NH4+、SO42-为正四面体结构,可推测PH4+、PO43-也为正四面体结构 |
| B.NaCl与CsCl化学式相似,故NaCl与CsCl的晶体结构也相似 |
| C.苯不能使酸性高锰酸钾溶液褪色,故苯的同系物也不能使酸性高锰酸钾溶液褪色 |
| D.CO2通入Ca(ClO)2溶液生成CaCO3和HClO,SO2通入Ca(ClO)2溶液也生成CaSO3和HClO |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.C60中不可能含有离子键 | B.C60中的化学键只有共价键 |
| C.C60是一种新型的化合物 | D.C60和金刚石都是由碳元素组成的单质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com