
【题目】写出下列反应的离子方程式
(1)碳酸钙与稀盐酸混合 ______________________________。
(2)铝与氢氧化钠溶液反应 ______________________。
科目:高中化学 来源: 题型:
【题目】化合物Ⅳ为一种重要化工中间体,其合成方法如下: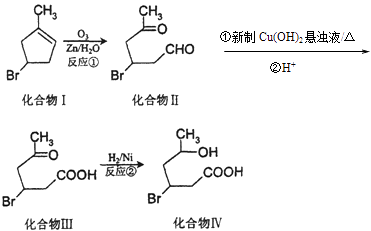
(1)化合物Ⅰ在核磁共振氢谱图吸收峰个数为;反应②的反应类型为 .
(2)化合物Ⅱ与新制Cu(OH)2悬浊液反应,写出该反应的化学方程式 .
(3)化合物I在NaOH醇溶液中加热反应得到化合物X,X的结构简式可能是 . (写出任意一种的结构简式).
(4)化合物III与足量NaOH水溶液加热反应的化学方程式为 .
(5)异黄樟油素 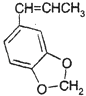 发生类似反应①的反应,得到乙醛和化合物Y,Y的结构简式为 .
发生类似反应①的反应,得到乙醛和化合物Y,Y的结构简式为 .
(6)有关上述化合物,说法不正确的是
A.1mol化合物Ⅲ,最多可与2molH2反应
B.化合物Ⅳ在一定条件下能与HBr反应
C.化合物Ⅰ能使酸性高锰酸钾溶液褪色
D.化合物Ⅳ在一定条件下能发生缩聚反应
E.化合物Ⅱ分子式为C6H11O2Br.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胶状液氢(主要成分是H2和CH4)有望用于未来的运载火箭和空间运输系统.实验测得101kPa时,1 molH2完全燃烧生成液态水,放出285.8kJ的热量;1 mol CH4完全燃烧生成液态水和CO2 , 放出890.3kJ的热量.下列热化学方程式书写正确的是( )
A.2H2(g)+O2(g)═2H2O(l)△H=﹣285.8 kJmol
B.CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=﹣890.3 kJmol
C.CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=﹣890.3 kJmol
D.CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=+890.3 kJmol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁中发生的基本反应之一如下:FeO(s)+CO(g)Fe(s)+CO2(g)(正反应是吸热反应),其平衡常数可表示为K= ![]() ,已知1100℃时K=0.263
,已知1100℃时K=0.263
(1)温度升高,化学平衡移动后达到新的平衡,高炉内CO2和CO的体积比值;平衡常数K值(选填“增大”“减小”或“不变”)
(2)1100℃时测得高炉中c(CO2)=0.025molL﹣1、c(CO)=0.1molL﹣1 , 在这种情况下,该反应是否处于化学平衡状态(选填“是”或“否”),此时,化学反应速率是v(正)v(逆)(选填“大于”“小于”或“等于”),其原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列方程式
(1)浓硫酸和铜反应的化学方程式是__________________________________________;
(2)实验室制取氨气反应的化学方程式为__________________________________________;
(3)制取漂白粉的化学反应方程式为__________________________________________;
(4)铁与足量稀硝酸反应的离子方程式为_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在原电池和电解池的电极上所发生的反应,属于还原反应的是( )
A.原电池的正极和电解池的阳极所发生的反应
B.原电池的正极和电解池的阴极所发生的反应
C.原电池的负极和电解池的阳极所发生的反应
D.原电池的负极和电解池的阴极所发生的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LED产品的使用为城市增添色彩。下图是氢氧燃料电池驱动LED发光的一种装置示意图。下列有关叙述正确的是( )
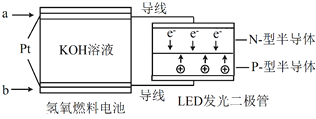
A. 电路中的电子从负极经外电路到正极,再经过KOH溶液回到负极,形成闭合回路
B. a处通入氢气, b处通氧气,该装置将化学能最终转化为电能
C. 电池放电后, OH-的物质的量浓度减小
D. 通入O2的电极发生反应:O2 + 4e- = 2O2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组利用图1装置进行CO2与饱和Na2CO3溶液反应制备NaHCO3 . 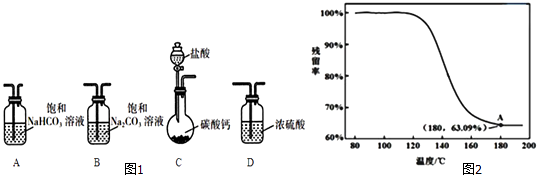
(1)选取必要的实验装置,正确的连接顺序为(填序号).
(2)为确定制得的固体样品是纯净的NaHCO3 , 小组同学提出下列实验方案:甲方案:将样品溶液与饱和澄清石灰水反应,观察现象.
乙方案:将样品溶液与BaCl2溶液反应,观察现象.
丙方案:测定pH法.
丁方案:热重分析法.
①判定甲方案(填“可行”或“不可行”).
②为判定乙方案的可行性,某同学用纯净的NaHCO3配制的溶液,与BaCl2溶液等体积混合进行实验,结果如下:
NaHCO3溶液 | 0.2molL﹣1 | 0.1molL﹣1 | 0.02molL﹣1 |
0.2molL﹣1 | 浑浊 | 浑浊 | 少许浑浊 |
0.1molL﹣1 | 浑浊 | 少许浑浊 | 无现象 |
0.02molL﹣1 | 少许浑浊 | 无现象 | 无现象 |
(i)此实验已可说明乙方案是不可行的.请结合以下数据,并通过计算说明产生浑浊的原因.
[己知:0.l molL﹣1 NaHCO3溶液电离出的c(CO32﹣)为0.001lmolL﹣1 , Ksp(BaCO3)=5.1×10﹣9]
答: .
(ii)产生浑浊(伴有气体产生)的离子方程式 .
③用pH计测定的丙方案如下:
取m克的固体样晶溶解于水配成V mL的溶液,用pH计测pH:
还应补充的实验是:
④进行丁方案实验,得到固体残留率随温度变化的曲线如图2所示,根据A点坐标得到的结沦是 .
(残留率= ![]() ×100%)
×100%)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①﹣⑧在表中的位置,用化学用语回答下列问题: 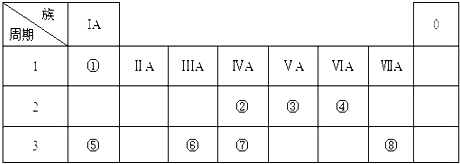
(1)④、⑤、⑥的原子半径由大到小的顺序为 .
(2)②、⑧、⑦的最高价含氧酸的酸性由强到弱的顺序是 .
(3)③的气态氢化物的电子式 .
(4)⑤的最高价氧化物对应水化物的溶液与单质⑥、单质⑧分别反应的离子方程式、 .
(5)单质①在单质⑧中燃烧,火焰为色.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com