
【题目】向BaCl2溶液中通入SO2将溶液分置于两支试管中,向一份中加入NaOH溶液,出现白色沉淀A,另一份通入少量Cl2,产生白色沉淀B,试回答下列问题:
(1)若不考虑SO2与水的反应向BaCl2溶液中通入SO2无明显现象,“无明显现象”可能是“不反应”,也可能是“反应但无现象”.此处应为 ,原因是 .
(2)沉淀A的化学式为 ,该沉淀能否溶于稀盐酸? _.
(3)写出生成沉淀B的离子方程式: .
(4)生成2.33 g沉淀B,需消耗标准状况下的Cl2 mL.
【答案】(1)不反应;H2SO3酸性小于盐酸;(2)BaSO3;(3)2H2O+SO2+Cl2+Ba2+=BaSO4↓+2Cl﹣+4H+;(4)224.
【解析】试题分析:(1)H2SO3酸性小于盐酸,所以SO2和BaCl2溶液不反应;
(2)SO2和NaOH溶液反应生成Na2SO3,Na2SO3和BaCl2发生复分解反应;亚硫酸盐沉淀能溶于稀盐酸;
(3)氯气具有强氧化性,SO2具有还原性,二者在水溶液里发生氧化还原反应生成H2SO4和盐酸,硫酸和氯化钡发生复分解反应;
(4)B是硫酸钡,根据S原子守恒计算SO2的物质的量,再结合转移电子守恒计算氯气的体积.
解:(1)H2SO3酸性小于盐酸,亚硫酸和BaCl2混合不符合复分解反应的条件,所以SO2和BaCl2溶液不反应,故答案为:不反应;H2SO3酸性小于盐酸;
(2)SO2和NaOH溶液反应生成亚硫酸钠,亚硫酸钠和BaCl2发生复分解反应生成BaSO3,所以A为BaSO3,BaSO3能溶于稀盐酸,故答案为:BaSO3;
(3)氯气具有强氧化性,二氧化硫具有还原性,二者在水溶液里发生氧化还原反应生成硫酸和盐酸,硫酸和氯化钡发生复分解反应,离子方程式为2H2O+SO2+Cl2+Ba2+=BaSO4↓+2Cl﹣+4H+,故答案为:2H2O+SO2+Cl2+Ba2+=BaSO4↓+2Cl﹣+4H+;
(4)B是硫酸钡,n(BaSO4)=![]() =0.01mol,根据S原子守恒知n(BaSO4)=n(SO2)=0.01mol,
=0.01mol,根据S原子守恒知n(BaSO4)=n(SO2)=0.01mol,
根据转移电子守恒知参加反应的n(SO2)=n(Cl2)=0.01mol,则V(Cl2)=0.01mol×22.4L/mol=0.224L=224mL,
故答案为:224.


科目:高中化学 来源: 题型:
【题目】研究催化剂对化学反应有重要意义.为探究催化剂对双氧水分解的催化效果,某研究小组做了如下实验: 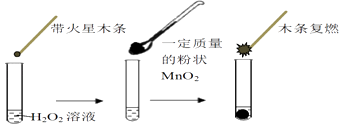
(1)甲同学欲用上图所示实验来证明MnO2是H2O2分解反应的催化剂,写出该反应的化学方程式
(2)为探究MnO2的质量对催化效果的影响,乙同学分别量取50mL 1% H2O2加入容器中,在一定质量范围内,加入不同质量的MnO2 , 测量所得气体体积,数据如表:
MnO2的质量/g | 0.1 | 0.2 | 0.4 |
40s末O2体积/mL | 49 | 61 | 86 |
由此得出的结论是 .
(3)为分析Fe3+和Cu2+对H2O2分解反应的催化效果,丙同学设计如表实验(三支试管中均盛有10mL 5% H2O2 ):
试管 | Ⅰ | Ⅱ | Ⅲ |
滴加试剂 | 5滴0.1molL﹣1FeCl3 | 5滴0.1molL﹣1 CuCl2 | 5滴0.3molL﹣1 NaCl |
产生气 | 较快产生细小气泡 | 缓慢产生细小气泡 | 无气泡产生 |
结论是 , 实验Ⅲ的目的是 .
(4)查阅资料得知:将作为催化剂的FeCl3溶液加入H2O2溶液后,溶液中会发生两个氧化还原反应,且两个反应中H2O2均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的化学方程式分别是2FeCl3+H2O2=2FeCl2+O2↑+2HCl和 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸碱中和滴定的方法测定NaOH和Na2CO3的混合液中的NaOH含量时,可先在混合液中加过量的BaCl2溶液,使Na2CO3完全变成BaCO3沉淀,然后用标准盐酸滴定(用酚酞作指示剂),下列有关实验的说法正确的是( )
A.向混有BaCO3沉淀的NaOH溶液中滴入盐酸,不会影响NaOH含量的测定
B.滴定时,若滴定管中滴定液一直下降到活塞处才达到滴定终点,则不会影响计算结果
C.若用甲基橙作指示剂,则测定结果偏小
D.可以不用将Na2CO3完全变成BaCO3沉淀,直接滴加标准盐酸,至不再有气泡产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH在表示溶液的酸碱性方面有重要的应用,请按要求完成填空
(1)常温下,pH=12的NaOH溶液的其浓度c(NaOH)=mol/L
(2)常温下,某一元弱酸溶液的pH=1,其浓度0.1mol/L(填“>”、“<”或“=”);
(3)常温下,将100mL 0.1mol/L醋酸溶液和50mL 0.2mol/LNaOH溶液均匀混合后,溶液显(填“酸性”、“碱性”或“中性”),其原因是;(请用相关的离子方程式作答)
(4)25℃时,若体积为Va、pH=a的某一元强酸HA与体积为Vb、pH=b的某一元强碱BOH混合恰好中和,且已知Va<Vb和a=0.5b,则 a的取值范围是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究氨气的溶解性,某兴趣小组按如图所示装置进行实验(f为止水夹),请回答下列问题:
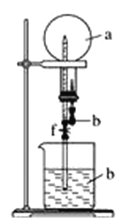
(1)写出实验室制取氨气的化学方程式____________________。
(2)要得到干燥的氨气可选用________(填字母)作干燥剂。
A.碱石灰 B.浓硫酸 C.浓硝酸 D.氢氧化钠溶液
(3)用如图装置进行喷泉实验,烧瓶中已装满干燥氨气(标准状况),引发水向上喷的操作是__________该实验的原理是_____________。
(4)则标准状况下,做完实验后烧瓶中溶质的物质的量浓度是________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的短周期主族元素.通常状况下,X与W元素均能形成﹣1价的气态氢化物,Y为同周期主族元素中原子半径最大的元素.X、Z和W的原子最外层电子教之和为20.回答下列问题:
(1)X在兀素周期表中的位置是 .
(2)X和Y元素简单离子的半径较大的是(填离子符号);Z和W元素气态氢化物的稳定性较强的是(填化学式).
(3)Y的氧化物中既含离子键又含共价键的是(用电子式表示).
(4)Z的最高价氧化物对应水化物的浓溶液(过量)和氧化亚铜共热,反应的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在选项条件下一定能大量共存的是
A. 无色溶液:Na+、Fe2+、Cl-、 SO42-
B. 酸性溶液:NH4+、 Fe3+、I-、SO42-
C. 碱性溶液:K+、Mg2+、SO42-、NO3-
D. 遇酚酞变红的溶液:Na+、K+、SO42-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家将石墨烯(由石墨剥离的层状结构)和碳纳米管经低温脱水处理,获得了一种“最轻材料”。该材料具有超强的吸附能力,且有望成为理想的储能保温、催化载体和吸音材料。下列有关说法正确的是( )
A.石墨烯属于有机物B.该材料吸油过程为物理变化
C.碳纳米管是碳的一种同位素D.碳纳米管属于胶体分散系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】矿泉水目前已成为人们常用的饮料,市场上有些不法商贩为牟取暴利,用自来水冒充矿泉水出售,为辨别真假,可用下列的一种化学试剂来鉴别,该试剂是
A. 酚酞试液B. 氯化钡溶液C. 氢氧化钠溶液D. 硝酸银溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com