



科目:高中化学 来源: 题型:
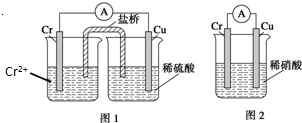 金属铬和氢气在工业上都有重要的用途.已知:铬能与稀硫酸反应,生成氢气和硫酸亚铬(CrSO4).
金属铬和氢气在工业上都有重要的用途.已知:铬能与稀硫酸反应,生成氢气和硫酸亚铬(CrSO4).查看答案和解析>>
科目:高中化学 来源: 题型:
| 操作 | 现象 | 结论 | |
| A | 将水蒸气通过灼热的铁粉 | 粉末变红 | 铁与水在高温下发生反应 |
| B | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变深 | 反应2NO2(g)?N2O4(g);△H<0 |
| C | 将少量的溴水分别滴入FeCl2溶液、NaI溶液中,再分别滴加CCl4振荡 | 上层分别呈无色和紫红色 | 还原性:I->Br->Fe2+ |
| D | 向溶液X中加入稀盐酸,并将产生的无色气体通入澄清石灰水中 | 生成白色沉淀 | 溶液X中一定含有 CO32-或 SO32- |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
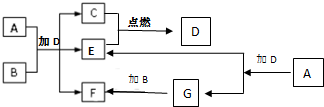 下列框图中各物质均为中学常见物质.A是淡黄色固体化合物,B、C、E为单质,其中C、E为气体,B为金属.常温、常压下D为无色液体.
下列框图中各物质均为中学常见物质.A是淡黄色固体化合物,B、C、E为单质,其中C、E为气体,B为金属.常温、常压下D为无色液体.查看答案和解析>>
科目:高中化学 来源: 题型:
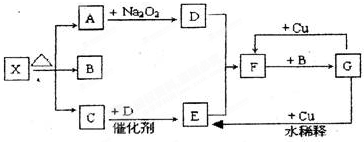
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | U | V | W | X | Y | Z | M |
| 原子半径/nm | 0.037 | 0.157 | 0.074 | 0.075 | 0.077 | 0.143 | 0.102 |
| 主要化合价 | +1 | +1 | -2 | -3,+5 | +2,+4 | +3 | -2,+6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
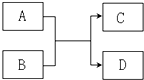 已知由短周期元素组成的物质 A、B、C、D,具有如图反应关系:
已知由短周期元素组成的物质 A、B、C、D,具有如图反应关系:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com