
���� ��1��FeS2������������FeS2��SԪ����������=��������Ʒ��SԪ������������
��2������Ԫ���غ㣬�ɵù�ϵʽ��2H2SO4��FeS2����ÿһ���������ʡ���ʧ�ʶ�ת��ΪFeS2�������ʣ��ٽ�Ϲ�ϵʽ���㣻
��3����FeS2Ϊ1 mol��������ȫ������Ҫ��n��O2�������ɵ�n��SO2������Ͽ���������������������������ʵ���������¯�������ʵ�������������SO2���������
��4����¯��Ϊ100mol����SO2Ϊ11mol��O2Ϊ9mol������Ϊ100mol-11mol-9mol=80mol������4FeS2+11O2=2Fe2O3+8SO2���������������ʵ����������Ǽ��㸻�������е��������������
��� �⣺��1������������Ԫ�غ���=FeS2�ĺ�����FeS2��SԪ��������������w��FeS2����$\frac{64}{120}$=35%�����w��FeS2��=65.6%��
�ʴ�Ϊ��65.6%��
��2����ɵ�98%��Ũ���������Ϊx���������غ�ã�
2H2SO4��FeS2
2��98t 120t
98%x 500t��60%����1-5%����90%
$\frac{2��98t}{98%x}=\frac{120t}{500t��60%����1-5%����90%}$
��֮�ã�x=427.5t��
�ʴ�Ϊ��427.5t��
��3����FeS2Ϊ1 mol����3FeS2+8O2��Fe3O4+6SO2 ��֪����ȫ������Ҫ��n��O2��=1mol��$\frac{8}{3}$������n��SO2��=2 mol����Ҫ�������ʵ���n��������=$\frac{8}{3}$mol��0.2=$\frac{40}{3}$mol����Ӧ¯�����ʵ���Ϊ2mol+$\frac{40}{3}$mol��$\frac{4}{5}$=$\frac{38}{3}$mol����¯����SO2������������SO2%=$\frac{2mol}{\frac{38}{3}mol}$��100%=15.8%��
������¯����SO2���������Ϊ15.8%��
��4����¯��Ϊ100mol����SO2Ϊ11mol��O2Ϊ9mol������Ϊ100mol-11mol-9mol=80mol������4FeS2+11O2=2Fe2O3+8SO2��֪����������Ϊ11mol��$\frac{11}{8}$���ʸ��������е��������ʵ���Ϊ11mol��$\frac{11}{8}$+9mol=$\frac{193mol}{8}$�����������е��������������Ϊ��$\frac{\frac{193}{8}mol}{\frac{193mol}{8}+80mol}$��100%=23.2%��
�𣺸��������е������������Ϊ23.2%��
���� ���⿼�黯ѧ����ʽ���㣬���ؿ���ѧ���ķ���������������Ŀ���������̸��ӣ�Ϊ�״���Ŀ��ע�⸳ֵ����Ӧ�ã��Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 3Fe+4H2O$\frac{\underline{\;����\;}}{\;}$Fe3O4+4H2 | B�� | 3NO2+H2O�T2HNO3+NO | ||
| C�� | 2Na2O2+2H2O�T4NaOH+O2�� | D�� | 2F2+2H2O�T4HF+O2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 ����ϩ��SO2 ������ϩ
����ϩ��SO2 ������ϩ| A�� | �٢ޢ� | B�� | �٢ۢܢ� | C�� | �٢ܢ� | D�� | �٢ۢޢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
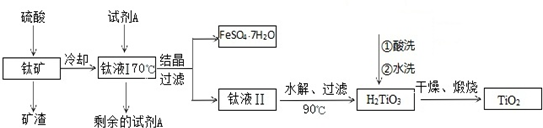
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
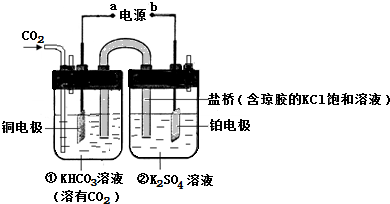
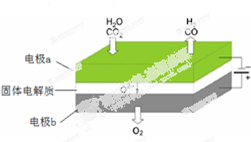
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
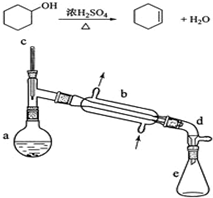 ����ˮ�Ǻϳ�ϩ���ij��÷�����ʵ���Һϳɻ���ϩ�ķ�Ӧ��ʵ��װ�����£�
����ˮ�Ǻϳ�ϩ���ij��÷�����ʵ���Һϳɻ���ϩ�ķ�Ӧ��ʵ��װ�����£�| ��Է������� | �ܶȣ�g/cm3�� | �е�/�� | �ܽ��� | |
| ������ | 100 | 0.9618 | 161 | ����ˮ |
| ����ϩ | 82 | 0.8102 | 83 | ������ˮ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | pH=0����Һ��K+��Ca2+��HCO3-��NO3- | |
| B�� | ���ڽ϶��Na+��SO42-��OH-������Һ�У�Mg2+��Ba2+��Br- | |
| C�� | ʹ��ɫʯ���������Һ��K+��Na+��CH3COO-��SO42- | |
| D�� | ��ˮ�������c��H+��Ϊ1��10-10 mol/L��Һ�У�K+��Fe2+��SO42-��NO3- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �μ���������Һ | B�� | �μ�̼������Һ | C�� | �μ��Ȼ�����Һ | D�� | �μӷ�̪��Һ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com