
| A. | 小于1.2 mol | B. | 1.2 mol | C. | 大于1.6 mol | D. | 1.6 mol |
分析 先根据反应进行到4min时二氧化硫的物质的量计算出平均反应速率,然后根据此速率计算出2min时消耗的二氧化硫的物质的量和剩余的二氧化硫的物质的量,根据反应时间越小,反应速率越大判断反应进行到2min时,密闭容器中SO2物质的量.
解答 解:当反应进行到4min时,二氧化硫的平均反应速率为:v=$\frac{△c}{△t}$=$\frac{\frac{2mol-0.4mol}{2L}}{4min}$=0.2mol/(L•min),
按照此反应速率,2min时消耗的二氧化硫的物质的量为:n(SO2)=2min×2L×0.2mol/(L•min)=0.8mol,
由于浓度越大,反应速率越快,2min内二氧化硫的浓度大于4min内的浓度,所以2min时消耗的二氧化硫的物质的量大于0.8mol,
反应进行到2min时,密闭容器中SO2物质的量小于(2mol-0.8mol)=1.2mol,
故选A.
点评 本题考查了化学反应速率的计算,题目难度中等,要求掌握化学反应速率的计算方法,本题的关键是理解随着反应的进行,反应物的浓度逐渐降低,从而导致反应速率逐渐降低这一客观事实,然后列式计算即可,试题有利于培养学生的分析、理解能力.


科目:高中化学 来源: 题型:选择题
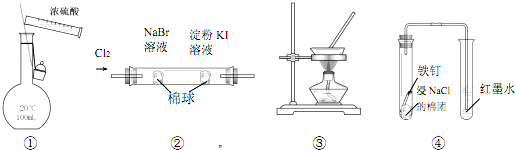
| A. | 图①装置可用于配制 100 mL 0.1 mol/L的硫酸 | |
| B. | 图②装置可证明氧化性:Cl2>Br2>I2 | |
| C. | 图③装置可通过蒸干AlCl3饱和溶液制备AlCl3晶体 | |
| D. | 图④装置可观察铁的吸氧腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
| 分装时期 | |
| 分装企业 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 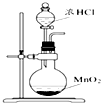 可用装置甲制取氯气 | |
| B. | 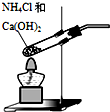 可用装置乙制取氨气 | |
| C. | 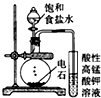 可用装置丙制取并检验乙炔(乙炔中含有H2S、PH3) | |
| D. |  可用装置丁制得金属锰 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气:K+ Ba2+ SiO32- NO3- | |
| B. | 氨气:K+ Na+ AlO2- CO32- | |
| C. | 二氧化硫:Na+ NH4+ SO32- C1- | |
| D. | 甲醛:Ca2+ Mg2+ Mn04- NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
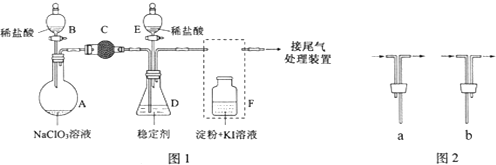
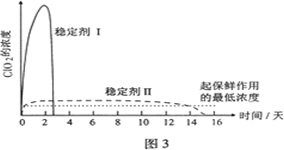
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(NH3)=0.06mol.L-1•min-1 | B. | v(H2)=0.04mol.L-1•min-1 | ||
| C. | v(NH3)=0.12mol.L-1•min-1 | D. | v(N2)=0.24mol.L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 尿素CO(NH2)2是一种氮肥 | |
| B. | 储存碳酸氢铵时,应密封并置于阴凉通风处 | |
| C. | 铵态氮肥不能与碱性物质如草木灰等混合施用 | |
| D. | 氮肥溶于水,其中的氮元素均以铵离子形式在存 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
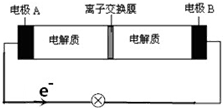 如图装置是一种可充电电池示意图,装置的离子交换膜只允许Na+通过.已知充、放电的化学方程式为2Na2S2+NaBr3$?_{充电}^{放电}$Na2S4+3NaBr,下列说法正确的是( )
如图装置是一种可充电电池示意图,装置的离子交换膜只允许Na+通过.已知充、放电的化学方程式为2Na2S2+NaBr3$?_{充电}^{放电}$Na2S4+3NaBr,下列说法正确的是( )| A. | 充电时,A极应与直流电源正极相连接 | |
| B. | 放电时,当有0.1molNa+通过离子交换膜时,B极上有0.3molNaBr产生 | |
| C. | 放电时,钠离子从左到右通过离子交换膜 | |
| D. | 放电时,负极反应式为3NaBr-2e-═NaBr3+2Na+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com