
| A. | FeCl2 | B. | Na2O | C. | SO2 | D. | NO |
科目:高中化学 来源: 题型:选择题
| A. | 以X浓度变化表示的反应速率为0.01mol•L-1•S-1 | |
| B. | 将容器体积变为2L,Z的平衡浓度变为原来的$\frac{1}{2}$ | |
| C. | 若增大压强,则物质Y的转化率减小 | |
| D. | 若升高温度,X的体积分数增大,则该反应的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
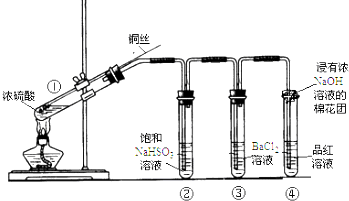
| 加入试剂 | 现象 | 反应的离子方程式 | |
| 第一份 | 加入NaOH溶液 | 有白色沉淀生成 | SO2+2OH-═SO32-+H2OBa2++SO32-═BaSO3↓ |
| 第二份 | 加入氯水 | 有白色沉淀生成 | SO2+Cl2+H2O═4H++2Cl-+SO42-Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{n(S{O}_{2})}{n({H}_{2})}$=$\frac{1}{1}$ | B. | $\frac{n(S{O}_{2})}{n({H}_{2})}$=$\frac{4}{1}$ | C. | $\frac{n(S{O}_{2})}{n({H}_{2})}$=$\frac{1}{4}$ | D. | $\frac{n(S{O}_{2})}{n({H}_{2})}$=$\frac{3}{2}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3、O2、HCl | B. | N2、O2、CO2 | C. | CO2、NO、O2 | D. | N2、H2S Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口倒出 | |
| B. | 使用容量瓶的第一步操作是先将容量瓶用蒸馏水洗涤后烘干 | |
| C. | 检验某溶液是否含有SO42-时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸 | |
| D. | 用10mL量筒量取9.2mL NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
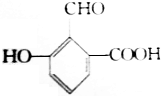 具有的三种官能团分别是:羟基、醛基和羧基,所以这种化合物可看作酚类、醛类和羧酸类.
具有的三种官能团分别是:羟基、醛基和羧基,所以这种化合物可看作酚类、醛类和羧酸类.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用湿润的有色布条 | B. | 用湿润的蓝色石蕊试纸 | ||
| C. | 将气体通入硝酸银溶液 | D. | 用湿润的淀粉碘化钾试纸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com