
目前,“低碳经济”备受关注,CO2的产生及有效开发利用成为科学家研究的重要课题。试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为: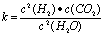 它所对应的化学反应为:
它所对应的化学反应为:
(2)—定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器中,发生(1)中反应:其相关数据如下表所示:
| 容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | |
| C(s) | H2O(g) | H2(g) | ||||
| 甲 | 2 | T1 | 2 | 4 | 3.2 | 8 |
| 乙 | 1 | T2 | 1 | 2 | 1.2 | 3 |
①T1℃时,该反应的平衡常数K=
②乙容器中,当反应进行到1.5min时,H2O(g)的物质的量浓度 (填选项字母)。
A. =0.8 mol·L-1 B. =1.4 mol·L-1 C. <1.4 mol·L-1 D. >1.4 mol·L-1
③丙容器的容积为1L,T1℃时,按下列配比充入C(s)、H2O(g)、CO2(g)和H2(g), 达到平衡时各气体的体积分数与甲容器完全相同的是 (填选项字母)。
A. 0.6 mol 1.0 mol 0.5 mol 1.0 mol B. 0.6 mol 2.0 mol 0 mol 0 mol
C. 1.0 mol 2.0 mol 1.0 mol 2.0 mol D. 0.25 mol 0.5 mol 0.75 mol 1.5 mol
(3)将燃煤废气中的CO2转化为甲醚的反应原理为:
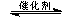 2CO2(g) + 6H2(g) CH3OCH3(g) + 3H2O(g)
2CO2(g) + 6H2(g) CH3OCH3(g) + 3H2O(g)
已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
| 投料比[n(H2) / n(CO2)] | 500 K | 600 K | 700 K | 800 K |
| 1.5 | 45% | 33% | 20% | 12% |
| 2.0 | 60% | 43% | 28% | 15% |
| 3.0 | 83% | 62% | 37% | 22% |
①该反应的焓变△H 0,熵变△S 0(填>、<或=)。
②用甲醚作为燃料电池原料,在碱性介质中该电池负极的电极反应式 。
若以1.12 L·min-1(标准状况)的速率向该电池中通入甲醚(沸点为-24.9 ℃),用该电池电解500 mL 2 mol·L-1 CuSO4溶液,通电0.50 min后,理论上可析出金属铜
g。
科目:高中化学 来源: 题型:
主族元素W、X、Y、Z位于同一周期,原子序数依次增大,W、X是金属元素,Y、Z是非金属元素。W、X的最高价氧化物对应的水化物可以相互反应,W与Y可形成化合物W2Y,Y的最外层电子数是核外电子层数的2倍。下列说法正确的是( )
A.Y的气态氢化物比Z的气态氢化物稳定
B.W的最高价氧化物对应的水化物是最强的碱
C.Y的单质和氧气、氢气都能发生化合反应,且反应产物都具有还原性
D.W、X、Y、Z四种元素的原子半径由小到大的顺序是W<X<Y<Z
查看答案和解析>>
科目:高中化学 来源: 题型:
燃料电池的设计原理是基于将燃料燃烧时的化学能转变为电能,所以凡是燃料的燃烧反应从原理上说都可以设计成原电池反应,下列说法正确的是( )
|
| A. | 燃料电池工作时O2在正极上发生氧化反应 |
|
| B. | 燃料电池工作时O2在负极上发生氧化反应 |
|
| C. | 燃料电池工作时燃料在负极上发生还原反应 |
|
| D. | 燃料电池若以KOH溶液为介质,则工作时不会产生CO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z和W代表原子序数依次增大的四种短周期主族元素,它们满足以下条件:①元素周期表中,Z与Y相邻,Z与W也相邻;②Y、Z和W三种元素的原子最外层电子数之和为17.请填空(用元素符号或化学用语):
(1)Y是 ,Z是 ,W是 ;
(2)Y元素的最高价氧化物的化学式是 ,其对应的水化物分子式是 ;
(3)X、Y、Z和W可组成一化合物,其原子个数之比为8:2:4:1.该化合物的化学式 4,其中存在的化学键类型有 ;
(4)上述四种元素中,非金属性最强的是 ,非金属性最弱的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是在相同温度下三种酸的一些数据,下列判断正确的是
| 酸 | HX | HY | HZ | ||
| 浓度(mol/L) | 0.12 | 0.2 | 0.9 | 1 | 1 |
| 电离度 | 0.25 | 0.2 | 0.1 | 0.3 | 0.5 |
| 电离常数 | K1 | K2 | K3 | K4 | K5 |
A.在相同温度,从HX的数据可以说明:弱电解质溶液,浓度越低,电离度越大,且K1>K2>K3=0.01
B.室温时,若在NaZ溶液中加水,则c((Z-)/ [c(HZ)• c(OH-)]的比值变小,若加少量盐酸,则比值变大
C.等物质的量的NaX、NaY和NaZ的混合液,c(X-)+c(Y-)-2c(Z-)=2c(HZ)-c(HX)-c(HY),且c(Z-)<c(Y-)<c(X-)
D.在相同温度下,K5>K4>K3
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:101 kPa时,1 mol辛烷完全燃烧生成CO2和液态水时放出热量为5 518 kJ,强酸与强碱在稀溶液中发生反应生成1 mol H2O时放出的热量为57.3 kJ,则下列热化学方程式书写正确的是( )
A.C8H18(l)+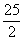 O2(g)====8CO2(g)+9H2O(g) ΔH=+5 518 kJ·mol-1
O2(g)====8CO2(g)+9H2O(g) ΔH=+5 518 kJ·mol-1
B.C8H18(l)+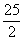 O2(g)====8CO2(g)+9H2O(l) ΔH=-5 518 kJ·mol-1
O2(g)====8CO2(g)+9H2O(l) ΔH=-5 518 kJ·mol-1
C.H++OH-====H2O ΔH=-57.3 kJ·mol-1
D.2NaOH(aq)+H2SO4(aq)====Na2SO4(l)+2H2O(l) ΔH=+57.3 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学按如图所示的装置进行电解实验。下列说法中正确的是( )

A.电解过程中,铜电极上有H2产生
B.电解初期,主要反应方程式为
Cu+H2SO4 CuSO4+H2↑
CuSO4+H2↑
C.电解一段时间后,石墨电极上有铜析出
D.整个电解过程中,H+的浓度不断增大
查看答案和解析>>
科目:高中化学 来源: 题型:
某二种气态混合烃1L,完全燃烧后生成1.4L CO2和1.6L水蒸气(体积均在相同条件下测得),该混合烃是( )
|
| A. | 乙烷、乙炔 | B. | 甲烷、乙炔 | C. | 甲烷、丙炔 | D. | 乙烷、丙炔 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com