
| 实验编号 | 容器体积/L | 温度/℃ |
| ① | 2.0 | 1200 |
| ② | 2.0 | 1300 |
| ③ | 1.0 | 1200 |

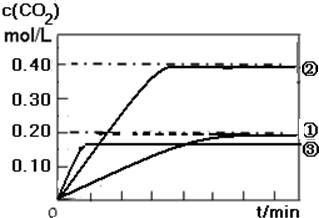 故答案为:
故答案为:
 CO2 (g)+H2(g)
CO2 (g)+H2(g)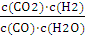 =
=| 0.4mol/L×0.4mol/L |
| 0.6mol/L×0.6mol/L |
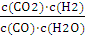 =
=| 0.5mol/L×0.5mol/L |
| 0.5mol/L×0.5mol/L |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 方案 | 第一步加入试剂 | 现象 | 第二步加入试剂 | 现象 | 结论 |
| 甲 | BaCl2溶液 | 白色沉淀 | 足量硝酸 | 沉淀不消失 | 有SO42- |
| 乙 | 足量盐酸 | 无 | BaCl2溶液 | 白色沉淀 | 有SO42- |
| 丙 | 足量硝酸 | 无 | Ba(NO3)2溶液 | 白色沉淀 | 有SO42- |
| A、甲 | B、乙 | C、丙 | D、都不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 解释与结论 |
| A | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2悬浊液,加热 | 无砖红色沉淀生成 | 淀粉没有水解生成葡萄糖 |
| B | 向某无色溶液中滴加硝酸酸化的Ba(NO3)2溶液 | 有白色沉淀产生 | 该溶液中一定含有SO42- |
| C | 向某钠盐中加入稀盐酸,将产生的气体通入澄清石灰水 | 澄清石灰水变浑浊 | 说明该盐一定是碳酸盐 |
| D | 向蔗糖中加入浓硫酸 | 变黑,放热,体积膨胀,放出刺激性气体 | 浓硫酸具有脱水性和强氧化性,反应中生成C、SO2和CO2等 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 第一电离能 | 电负性 | 晶格能 | 沸点 |
| Mg | O | MgO | H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 |
B、 |
C、 |
D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、苯乙烯在一定条件下制聚苯乙烯 |
| B、乙醇与浓硫酸共热制乙烯 |
| C、乙醇催化氧化制乙醛 |
| D、乙烷与氯气反应制氯乙烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com