
 =2Cr(OH)3↓+3O2↑+2H2O.
=2Cr(OH)3↓+3O2↑+2H2O.分析 该反应中H2O2→O2,O元素化合价升高,H2O2被氧化,作还原剂,则反应中H2CrO4为氧化剂,Cr元素的化合价降低,被还原为Cr(OH)3,所以H2CrO4发生如下过程:H2CrO4→Cr(OH)3,根据化合价的变化可知,反应的方程式为2H2CrO4+3H2O2=2Cr(OH)3+3O2↑+2H2O,根据化合价的变化判断电子转移的数目,以此解答该题.
解答 解:①该反应中H2O2→O2,O元素化合价升高,H2O2被氧化,作还原剂,则反应中H2CrO4为氧化剂,Cr元素的化合价降低,被还原为Cr(OH)3,所以H2CrO4发生还原过程:H2CrO4→Cr(OH)3,故答案为:H2CrO4;Cr(OH)3;
②该反应中O元素失电子,Cr元素得到电子,2molH2CrO4反应转移电子为2mol×(6-3)=6mol,则用单线桥法标出电子转移的方向和数目为 =2Cr(OH)3↓+3O2↑+2H2O,
=2Cr(OH)3↓+3O2↑+2H2O,
故答案为: =2Cr(OH)3↓+3O2↑+2H2O;
=2Cr(OH)3↓+3O2↑+2H2O;
③由2H2CrO4+3H2O2═2Cr(OH)3↓+3O2↑+2H2O可知,生成3mol气体转移6mol电子,则转移了0.3mol电子,则产生的气体的物质的量为$\frac{0.3mol}{6}$×3=0.15mol,其在标准状况下体积为0.15mol×22.4L/mol=3.36L,故答案为:3.36L;
④因为H2O2作氧化剂,其还原产物是H2O,H2O没有毒性及污染性,故答案为:H2O2作氧化剂,其还原产物是H2O,H2O没有毒性及污染性.
点评 本题考查氧化还原反应,为高考常见题型,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
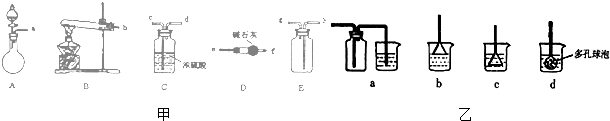
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
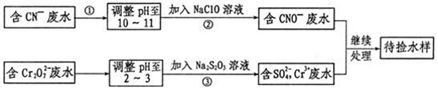
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
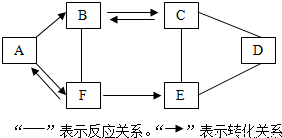
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol•L-1NaCl溶液含有NA个Na+ | |
| B. | 1mol Cl2与足量的铝反应,转移的电子数为3NA | |
| C. | 1 mol Na 与足量O2 反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 | |
| D. | 铁和酸反应,放出标准状况下的22.4L气体,转移的电子数必为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
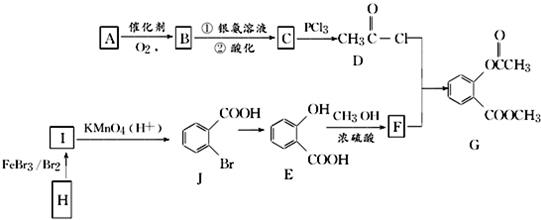
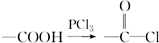
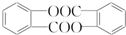 .
.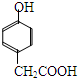 .
.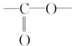 结构
结构查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com