
��Դ�Ŀ����������������Ŀɳ�����չϢϢ��ء�
��.��֪��Fe2O3(s)��3C(s)=2Fe(s)��3CO(g) ��H1��a kJ��mol��1
CO(g)��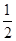 O2(g)=CO2(g)�� ��H2��b kJ��mol��1
O2(g)=CO2(g)�� ��H2��b kJ��mol��1
4Fe(s)��3O2(g)=2Fe2O3(s)�� ��H3��c kJ��mol��1
��C��ȼ���Ȧ�H��________ kJ��mol��1��
��.(1)����ԭ��صĹ���ԭ�������л�ѧ��Ӧ�������Ͽ�����Ƴ�ԭ��ص���________(�����)��
A��C(s)��CO2(g)=2CO(g)
B��NaOH(aq)��HCl(aq)=NaCl(aq)��H2O(l)
C��2H2O(l)=2H2(g)��O2(g)
D��2CO(g)��O2(g)=2CO2(g)
�������ڵ�K2CO3��CO2Ϊ��Ӧ�Ļ�����������ѡ��Ӧ��Ƴ�һ��ԭ��أ���д����ԭ��صĸ�����Ӧ��______________________________________
_______________________________________________________________��
(2)ijʵ��С��ģ�ҵ�ϳɰ���ӦN2(g)��3H2(g) 2NH3(g)����H����92.4 kJ��mol��1����ʼ���ǽ�N2��H2�������20 mol(�����1��1)����5 L�ϳ����У���ӦǰѹǿΪp0����Ӧ������ѹǿ��p��ʾ����Ӧ������
2NH3(g)����H����92.4 kJ��mol��1����ʼ���ǽ�N2��H2�������20 mol(�����1��1)����5 L�ϳ����У���ӦǰѹǿΪp0����Ӧ������ѹǿ��p��ʾ����Ӧ������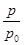 ��ʱ��t�Ĺ�ϵ��ͼ��ʾ��
��ʱ��t�Ĺ�ϵ��ͼ��ʾ��
��ش��������⣺
�ٷ�Ӧ��ƽ��ı�־��(����ĸ����)________��
A��ѹǿ���ֲ���
B�������ܶȱ��ֲ���
C��NH3������������N2���������ʵ�2��
��0��2 min�ڣ���c(N2)�仯��ʾ��ƽ����Ӧ����Ϊ________��
�������N2��ת���ʣ��ɲ�ȡ�Ĵ�ʩ��________��
A������ϵ�а������1��1�ٳ���N2��H2
B�������NH3
C�������¶�
D�����뺤��ʹѹǿ����
E������һ������N2
(3)25 ��ʱ��BaCO3��BaSO4���ܶȻ������ֱ���8��10��9��1��10��10��ij����BaCO3����������Һ�У�c(CO32��)��0.2 mol��L��1���������������Na2SO4��Һ����Ҫ����BaSO4����������Na2SO4��Һ�����ʵ���Ũ����С��________ mol��L��1��
 ���ٴ�����ɽ����ϵ�д�
���ٴ�����ɽ����ϵ�д� ���ٴ���������ѧϰ����ѧ�ں����ν�ϵ�д�
���ٴ���������ѧϰ����ѧ�ں����ν�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
���ǵ����Ϻ����ḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ������������������Ҫ���á�
��1���ڹ̶��ݻ����ܱ������У��������»�ѧ��Ӧ��N2��g��+3H2��g��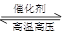 2NH3��g�� ��H=��92��4kJ/mol��
2NH3��g�� ��H=��92��4kJ/mol��
��ƽ�ⳣ��K���¶�T�Ĺ�ϵ���±���
| T/K | 298 | 398 | 498 |
| ƽ�ⳣ��K | 4.1��106 | K1 | K2 |
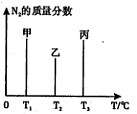
 ��NH2��2CO +H2O
��NH2��2CO +H2O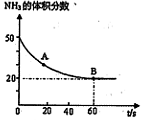
 ��CO2�� B����淴Ӧ����
��CO2�� B����淴Ӧ���� ��CO2������д��>����=����<������NH3��ƽ��ת����Ϊ____ ��
��CO2������д��>����=����<������NH3��ƽ��ת����Ϊ____ �� 2NO��g�� ��H =+180kJ/mol
2NO��g�� ��H =+180kJ/mol�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
���Ŵ�����Ⱦ����������,�����ܼ��š�,����ȫ�����������ŷ�,�о�NOx��SO2��CO�ȴ�����Ⱦ����Ĵ���������Ҫ���塣
(1)��ͼ����101 kPa��298 K������1 mol NO2��1 mol CO��Ӧ����1 mol CO2��1 mol NO�����������仯ʾ��ͼ��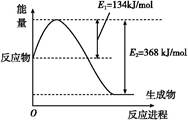
��֪:N2(g)+O2(g) 2NO(g)����H="+179.5" kJ/mol
2NO(g)����H="+179.5" kJ/mol
2NO(g)+O2(g) 2NO2(g)����H="-112.3" kJ/mol
2NO2(g)����H="-112.3" kJ/mol
����298 Kʱ,��Ӧ:2NO(g)+2CO(g) N2(g)+2CO2(g)�Ħ�H=��������
N2(g)+2CO2(g)�Ħ�H=�������� 
(2)��0.20 mol NO2��0.10 mol CO ����һ���ݻ��㶨Ϊ1 L���ܱ������з�����Ӧ,�ڲ�ͬ������,��Ӧ�����в������ʵ�Ũ�ȱ仯״����ͼ��ʾ��
������˵����ȷ������������(�����)��
a.�����ڵ�ѹǿ�������仯˵���÷�Ӧ�ﵽƽ��
b.�����������ٳ���0.20 mol NOʱ,ƽ��������Ӧ�����ƶ�,Kֵ����
c.�����¶Ⱥ�,Kֵ��С,NO2��ת���ʼ�С
d.��������ڳ���He��,��Ӧ��������С,Ũ������,���Է�Ӧ��������
�ڼ������NO2��0��2 minʱƽ����Ӧ����v(NO2)=��������mol/(L��min)��
�۵�4 minʱ�ı�ķ�Ӧ����Ϊ��������(����¡����¡�)��
�ܼ��㷴Ӧ�ڵ�6 minʱ��ƽ�ⳣ��K=�����������������¶Ȳ���,��ʱ���������г���CO��NO��0.060 mol,ƽ�⽫���������ƶ�(�������������)�� 
(3)��ѧ��������ͼ��ʾװ����ԭ���ԭ����SO2ת��Ϊ��Ҫ�Ļ���ԭ�ϡ��为���ķ�ӦʽΪ ������0.25 mol SO2������,��ͨ������(H+)����Ĥ��H+�����ʵ���Ϊ�������� ��
(4)CO2����Ȼ��ѭ��ʱ����CaCO3��Ӧ,CaCO3��һ����������,��Ksp=2.8��10-9���ֽ�2��10-4 mol/L��Na2CO3��Һ��һ��Ũ�ȵ�CaCl2��Һ�����������ɳ���,����Ӧ����CaCl2��Һ����СŨ��Ϊ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
̼���������ĵ��ʼ��仯�����ڹ�ũҵ����������������Ҫ���á�
��1�����̼�Ȼ�ԭһ�Ȼ�����ʵ���������Ʊ�������������ص��Ȼ�ѧ����ʽ���£�
2Al2O3��s��+ 2AlCl3��g��+ 6C��s����6AlCl��g��+ 6CO��g������H�� a kJ?mol-1
3AlCl��g���� 2Al��l��+ AlCl3��g������H�� b kJ?mol-1
��ӦAl2O3��s��+ 3C��s���� 2Al��l��+ 3CO��g���ġ�H�� kJ?mol-1
���ú�a��b�Ĵ���ʽ��ʾ����
��2���û���̿��ԭ�����Դ����������ij�о�С����ij�ܱ������м���һ�����Ļ���̿��NO��������ӦC��s��+ 2NO��g��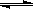 N2��g��+ CO2��g������H= Q kJ?mol-1����T1��ʱ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�
N2��g��+ CO2��g������H= Q kJ?mol-1����T1��ʱ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�
| ʱ�䣨min�� Ũ�ȣ�mol/L�� | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1��00 | 0��68 | 0��50 | 0��50 | 0��60 | 0��60 |
| N2 | 0 | 0��16 | 0��25 | 0��25 | 0��30 | 0��30 |
| CO2 | 0 | 0��16 | 0��25 | 0��25 | 0��30 | 0��30 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ѧ��Ҫ�о���̼Ԫ�ؼ��仯������صĺܶ���⡣
��1����̿��������ȡˮú�������12g̼��ˮ������ȫ��Ӧ����ˮú��ʱ��������131. 6kJ�������÷�Ӧ���Ȼ�ѧ����ʽ��_________ ��
��2����ҵ�Ͽ��ý�̿ұ����������0.5mol̼��ȫ�������Ӧ���õ�0.6mol����ͬʱ����2�ֳ������壬��÷�Ӧ�Ļ�ѧ����ʽ��_________��
��3��̼��ˮ������ˮú���ķ�Ӧ��һ�����淴Ӧ��������������жϸ÷�Ӧһ���ﵽƽ��״̬����_________��ѡ���ţ�����
| A��V��(H2O)=V��(H2) |
| B���������¶Ȳ��ٷ����ı� |
| C������nmolH2ͬʱ����nmolCO |
| D������������������ʵ�������ʱ��ı� |
 CO(g)+H2(g)��ƽ�ⳣ������ֵΪ_________���ڵ�5����ʱ����ϵ���·����ߵ�T2�����ڵ�8����ʱ�ﵽ�µ�ƽ�⣬������ͼ�л�����5���ӵ�9���Ӻ�c(H2O)Ũ�ȱ仯���Ƶ����ߣ�ֻҪ���Ա�ʾ����
CO(g)+H2(g)��ƽ�ⳣ������ֵΪ_________���ڵ�5����ʱ����ϵ���·����ߵ�T2�����ڵ�8����ʱ�ﵽ�µ�ƽ�⣬������ͼ�л�����5���ӵ�9���Ӻ�c(H2O)Ũ�ȱ仯���Ƶ����ߣ�ֻҪ���Ա�ʾ����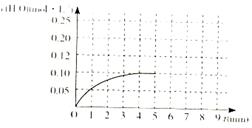
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ����
(1)��ҵ��һ������������ַ�Ӧ�ϳɼ״���
��Ӧ��CO(g)��2H2(g) CH3OH(g)����H1
CH3OH(g)����H1
��Ӧ��CO2(g)��3H2(g) CH3OH(g)��H2O(g)����H2
CH3OH(g)��H2O(g)����H2
��������Ӧ���ϡ�ԭ�Ӿ��á�ԭ�����________(���)��
���±����������Ƿ�Ӧ���ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ��(K)��
| �¶� | 250 �� | 300 �� | 350 �� |
| K | 2.041 | 0.270 | 0.012 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
������Ϊһ������Դ�ڻ�ѧ����Ӧ�ù㷺����ش��������⡣
(1)��¯ұ�������У������ڴ���Ӧ���в���ˮú��(CO��H2)��ԭ���������йط�ӦΪ��CH4(g)��CO2(g)===2CO(g)��2H2(g)����H��260 kJ��mol��1
��֪��2CO(g)��O2(g)===2CO2(g)
��H����566 kJ��mol��1��
��CH4��O2��Ӧ����CO��H2���Ȼ�ѧ����ʽΪ_________________________________��
(2)����ͼ��ʾ��װ�â�Ϊ����ȼ�ϵ��(�������ҺΪKOH��Һ)��ͨ��װ�â�ʵ�������϶�ͭ��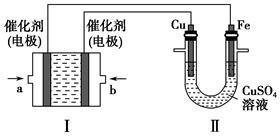
��a��Ӧͨ��________(�CH4����O2��)��b���缫�Ϸ����ĵ缫��Ӧʽ��__________________________________��
�ڵ�ƽ�����װ�â�����Һ��pH________(��д�������С�����䡱����ͬ)��װ�â���Cu2�������ʵ���Ũ��________��
�۵�ƽ�����װ�â���Һ�е������ӳ���OH���������________(����ˮ��)��
���ڴ˹���������ȫ��Ӧ��װ�â������������仯12.8 g����װ�â������������ļ���________L(��״����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ѧ��Ӧ�����з������ʱ仯��ͬʱ���������������ı仯�����������ı仯������������ʽ���ֳ�����������Ӧ�ȡ����ڷ�Ӧ�������ͬ����Ӧ�ȿ��Է�Ϊ�����֣���ȼ���Ⱥ��к��ȵȡ�
��1������ �� H ��ʾ����ȼ���ȵ��� ������ĸ��ţ���
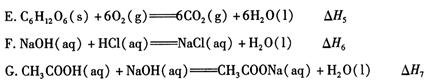
��2�����������Ȼ�ѧ����ʽ��ϡ����������������Һ�����кͷ�Ӧ���Ȼ�ѧ����ʽΪ ��������ЧӦ������ ��H1 ~��H7����ѡȡ����
��3���к��ȵIJⶨ�Ǹ��л�ѧ�Ķ���ʵ��֮һ�� 50 mL0.50 mol/L ������ 50 mL 0.55 mol/L NaOH ��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȡ���ʵ��װ���Ͽ���ͼ����ȱ�ٵ�һ�������ǡ����ձ����粻��Ӳֽ�壬��õ��к�����ֵ���ᣨ�ƫ����ƫС������Ӱ�족����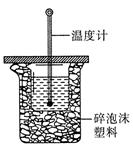
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
����������CO2���ڻ��ۣ���в����̬����������������ܵ�ȫ�����ע��
��1����ҵ�ϳ��ø�Ũ�ȵ�K2CO3��Һ����CO2������ҺX�������õ�ⷨʹK2CO3��Һ��������װ��ʾ��ͼ���£�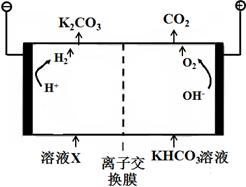
�������������ķ�Ӧ���� ��H ++ HCO3-=H2O+CO2����
����CO32-��������������ԭ�� ��
��2������װ���в�����CO2��H2��һ�������·�Ӧ���ɼ״��Ȳ����ҵ�����ø÷�Ӧ�ϳɼ״���
��֪��25 �棬101 KPa�£�
H2(g)+1/2 O2(g)=H2O(g) �� H1=" -242" kJ/mol
CH3OH(g)+3/2 O2(g)=CO2 (g)+2 H2O(g) �� H2=" -676" kJ/mol
д��CO2��H2������̬�״��Ȳ�����Ȼ�ѧ����ʽ ��
�����ʾ�ϳɼ״��ķ�Ӧ�������仯ʾ��ͼ��������ȷ���� ������ĸ��ţ���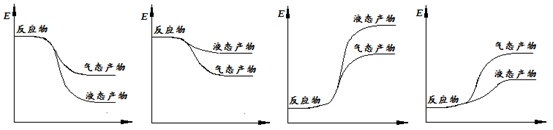
a b c d
��3������ȼ�ϵ����һ���������ォ��ѧ��ֱ��ת���ɵ��ܵ�װ�á���֪ij�ּ״�
����ȼ�ϵ���У��������ҺΪ���ԣ�ʾ��ͼ���£�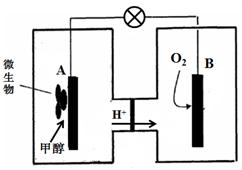
�õ�����·���ӵ���������Ϊ ����д����A��B����B��A������
����������B�缫����Һ��pH�빤��ǰ��Ƚ� ����д����������С�����䡱����Һ����仯���Բ��ƣ���
A�缫�����״������ĵ缫��ӦʽΪ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com