
相同体积、相同pH的某一元强酸溶液①和某一元中强酸溶液②分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是( )


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:
工业生产纯碱的工艺流程示意图如下:
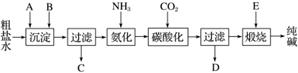
完成下列填空:
(1)粗盐水加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式:A________,B________。
(2)实验室提纯粗盐的实验操作依次为取样、________、沉淀、________、________、冷却结晶、________、烘干。
(3)工业生产纯碱工艺流程中,碳酸化时产生的现象是_______________________
________________________________________________________________________。
碳酸化时没有析出碳酸钠晶体,其原因是__________________________________________
________________________________________________________________________。
(4)碳酸化后过滤,滤液D最主要的成分是______________________(填写化学式),检验这一成分的阴离子的具体方法是:_____________________________________________。
(5)氨碱法流程中氨是循环使用的,为此,滤液D加入石灰水产生氨。加石灰水时所发生的反应的离子方程式为
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,在2 L的恒容密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
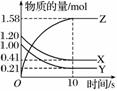
(1)从反应开始到10 s时,用Z表示的反应速率为__________,X的物质的量浓度减少了________,Y的转化率为______。
(2)该反应的化学方程式为______________________________________。
(3)10 s后的某一时刻(t1)改变了外界条件,其速率随时间的变化图像如图所示。则下列说法符合该图像的是______。
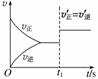
A.t1时刻,增大了X的浓度
B.t1时刻,升高了体系温度
C.t1时刻,缩小了容器体积
D.t1时刻,使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
按要求画出图像,并回答下列问题。
(1)相同体积、相同浓度的盐酸和醋酸
①加入足量的Zn,在甲图中画出H2体积的变化图像

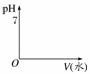
甲 乙
单位时间内,________产生的H2多,反应停止时,产生的H2________。
查看答案和解析>>
科目:高中化学 来源: 题型:
判断正误,正确的划“√”,错误的划“×”
(1)25 ℃时,用醋酸溶液滴定等浓度NaOH溶液至pH=7,V醋酸<VNaOH( )
(2013·重庆理综,2B)
(2)稀醋酸加水稀释,醋酸的电离程度增大,溶液的pH减小( )
(2012·重庆理综,10B)
(3)中和等体积、等物质的量浓度的盐酸和醋酸所消耗的n(NaOH)相等( )
(2012·福建理综,10C)
(4)CH3COOH溶液加水稀释后,溶液中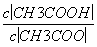 的值减小( )
的值减小( )
(2013·江苏,11C)
(5)室温下,对于0.10 mol·L-1的氨水,加水稀释后,溶液中c(NH )·c(OH-)变大( )
)·c(OH-)变大( )
(2013·福建理综,8B)
查看答案和解析>>
科目:高中化学 来源: 题型:
运用电离常数判断可以发生的反应是( )
| 酸 | 电离常数(25 ℃) |
| 碳酸 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
| 次溴酸 | Ki=2.4×10-9 |
①HBrO+Na2CO3===NaBrO+NaHCO3
②2HBrO+Na2CO3===2NaBrO+H2O+CO2↑
③HBrO+NaHCO3===NaBrO+H2O+CO2↑
④NaBrO+CO2+H2O===NaHCO3+HBrO
A.①③ B.②④
C.①④ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
常压下,取不同浓度、不同温度的氨水测定,得到下表实验数据。
| 温度(℃) | c(NH3·H2O) (mol·L-1) | 电离常数 | 电离度(%) | c(OH-) (mol·L-1) |
| 0 | 16.56 | 1.37×10-5 | 9.098 | 1.507×10-2 |
| 10 | 15.16 | 1.57×10-5 | 10.18 | 1.543×10-2 |
| 20 | 13.63 | 1.71×10-5 | 11.2 | 1.527×10-2 |
提示:电离度= ×100%
×100%
(1)温度升高,NH3·H2O的电离平衡向________(填“左”或“右”)移动,能支持该结论的表中数据是______(填字母)。
a.电离常数 b.电离度
c.c(OH-) d.c(NH3·H2O)
(2)表中c(OH-)基本不变的原因是______________________________________。
(3)常温下,在氨水中加入一定量的氯化铵晶体,下列说法错误的是______(填字母,下同)。
A.溶液的pH增大 B.氨水的电离度减小
C.c(OH-)减小 D.c(NH )减小
)减小
(4)将氨水与盐酸等浓度等体积混合,下列做法能使c(NH )与c(Cl-)比值变大的是______。
)与c(Cl-)比值变大的是______。
A.加入固体氯化铵 B.通入少量氯化氢
C.降低溶液温度 D.加入少量固体氢氧化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,将E(g)和F(g)充入体积不变的2 L密闭容器中,发生下述反应,并于5 min末达到平衡:2E(g)+F(g)2G(g)。有关数据如下:
| E(g) | F(g) | G(g) | |
| 初始浓度/mol·L-1 | 2.0 | 1.0 | 0 |
| 平衡浓度/mol·L-1 | c1 | c2 | 0.4 |
下列判断正确的是( )
A.反应在前5 min内,v(E)=0.04 mol·L-1·min-1
B.其他条件不变,若增大E的浓度,则达平衡时E的转化率会增大
C.其他条件不变,降低温度,平衡时n(E)=3.0 mol,则反应的ΔH>0
D.平衡后移走2.0 mol E和1.0 mol F,在相同条件下再达平衡时,c(G)<0.2 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com