
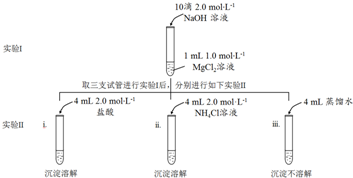
分析 (1)氢氧化钠与氯化镁反应生成氢氧化镁沉淀和氯化钠;
(2)氯化氢为强电解质完全电离,盐类水解是微弱的,据此分析解答;
(3)依据沉淀溶解平衡移动原理及影响因素解答;
(4)依据实验iii条件为加入蒸馏水判断解答;
(5)依据铵根离子能够水生成一水合氨和氢离子,铵根离子能够与氢氧根离子反应生成一水合氨的性质解答;
(6)向4mL 2mol•L-1 NH4Cl溶液中滴加2滴浓氨水,得到pH约为8的混合溶液,溶液呈碱性,如氢氧化镁能溶解,可说明NH4+结合OH-使沉淀溶解;
解答 解:(1)氢氧化钠与氯化镁反应生成氢氧化镁沉淀和氯化钠,离子方程式:Mg2++2OH-═Mg(OH)2↓;
故答案为:Mg2++2OH-═Mg(OH)2↓;
(2)由于盐酸中氯化氢为强电解质,完全电离,NH4+部分水解:NH4++H2O?NH3•H2O+H+,导致同浓度两溶液中,盐酸中H+浓度大于NH4Cl溶液中H+浓度,所以2.0mol•L-1盐酸pH1和2.0mol•L-1 NH4Cl溶液,盐酸中氢离子浓度大于氯化铵中氢离子浓度,所以pH1<pH2;
故答案为:<;由于盐酸完全电离,NH4+部分水解:NH4++H2O?NH3•H2O+H+,导致同浓度两溶液中,盐酸中H+浓度大于NH4Cl溶液中H+浓度
(3)氢氧化镁溶液中存储沉淀溶解平衡:Mg(OH)2(s)?Mg2+(aq)+2OH -(aq),加入盐酸后,盐酸中的H+与OH-中和使得OH-浓度减小,
平衡右移,沉淀溶解;
故答案为:Mg(OH)2(s)?Mg2+(aq)+2OH -(aq),盐酸中的H+与OH-中和使得OH-浓度减小,平衡右移,沉淀溶解;
(4)实验iii条件为只加蒸馏水,现象沉淀不溶解,可以排除实验i、ii中溶剂水使沉淀溶解的可能性;
故答案为:实验i、ii中溶剂水使沉淀溶解的可能性;
(5)铵根离子能够水生成一水合氨和氢离子,铵根离子能够与氢氧根离子反应生成一水合氨的性质,所以推测ii中沉淀溶解的原因:
推测一,NH4Cl溶液显酸性,溶液中的H+可以结合OH-,进而使沉淀溶解;推测二,溶液中c(NH4+)较大,NH4+结合OH-使沉淀溶解;
故答案为:溶液中c(NH4+)较大,NH4+结合OH-使沉淀溶解;
(6)向4mL 2mol•L-1 NH4Cl溶液中滴加2滴浓氨水,得到pH约为8的混合溶液,溶液呈碱性,如氢氧化镁能溶解,可说明NH4+结合OH-使沉淀溶解,配制理由:混合溶液显碱性,c(H+)非常小,c(NH4+)较大能确定是NH4+结合OH-使沉淀溶解,
故答案为:
①4 mL 2.0 mol•L-1 NH4Cl;
②二 理由:混合后溶液中c(H+)=10-8 mol•L-1非常小,c(NH4+)=2.0 mol•L-1较大,故能确定是NH4+结合OH-使沉淀溶解.
点评 本题考查较为综合,侧重于学生的分析能力和实验能力的考查,为高频考点,注意把握影响沉淀平衡,电离平衡和水解平衡的因素,综合把握相关基本理论知识,注重基础知识的学习,难度中等.


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:选择题
| A. | 过滤时,玻璃棒的末端应轻轻靠在三层滤纸上 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 称氢氧化钠时,不能直接称量,要放在纸片上称量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe(OH)3胶体区别于其他分散系的本质特征是分散质粒子的直径在10-9~10-7米之间 | |
| B. | 分别用一束光透过三种分散系,只有Fe(OH)3胶体具有丁达尔效应 | |
| C. | 往FeCl3溶液中加入NaOH溶液,并适当加热,可制得Fe(OH)3胶体 | |
| D. | 三种分散系中分散质均属于电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某学生探究AgCl、Ag2S沉淀转化的原因.
某学生探究AgCl、Ag2S沉淀转化的原因.| 步 骤 | 现 象 |
| Ⅰ.将NaCl与AgNO3溶液混合 | 产生白色沉淀 |
| Ⅱ.向所得固液混合物中加Na2S溶液 | 沉淀变为黑色 |
| Ⅲ.滤出黑色沉淀,加入NaCl溶液 | 较长时间后,沉淀变为乳白色 |
| 现象 | B.一段时间后,出现白色沉淀 |
| C.一点时间后,无明显变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
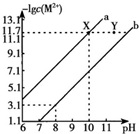 25℃时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[-lgC(M2+)]与溶液PH的变化关系如图所示,已知:该温度下,Ksp[Cu(OH)2]<Ksp[Fe(OH)2].下列说法正确的是( )
25℃时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[-lgC(M2+)]与溶液PH的变化关系如图所示,已知:该温度下,Ksp[Cu(OH)2]<Ksp[Fe(OH)2].下列说法正确的是( )| A. | b线表示Fe(OH)2饱和溶液中的变化关系,且Ksp[Fe(OH)2]=10-15.1 | |
| B. | 当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中C(Fe2+):C(Cu2+)=1:104.6 | |
| C. | 向X点对应的饱和溶液中加入少量NaOH,可转化为Y点对应的溶液 | |
| D. | 除去CuSO4溶液中含有的少量Fe2+,可加入适量CuO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/mol•L-1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)已知在2L的容器中进行下列可逆反应,各物质的有关数据如下:
(1)已知在2L的容器中进行下列可逆反应,各物质的有关数据如下:| 起始物质的量浓度(mol/L) | 1.5 | 1 | 0 |
| 2s末物质的量浓度(mol/L) | 0.9 | 0.8 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com