
 xC(g)+2D(s)��2minĩ�÷�Ӧ�ﵽƽ�⣬����0.8molD�������C��Ũ��Ϊ0.2mol/L�������ж���ȷ����( )
xC(g)+2D(s)��2minĩ�÷�Ӧ�ﵽƽ�⣬����0.8molD�������C��Ũ��Ϊ0.2mol/L�������ж���ȷ����( )| A���������´˷�Ӧ�Ļ�ѧƽ�ⳣ��ԼΪ0.91 |
| B��A��ƽ����Ӧ����Ϊ0.3mol/(L��s) |
| C��B��ת����Ϊ60% |
| D�������������ܶȲ��ٸı�ʱ���÷�Ӧ��һ���ﵽƽ��״̬ |
 C(g)+2D(s)
C(g)+2D(s)


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
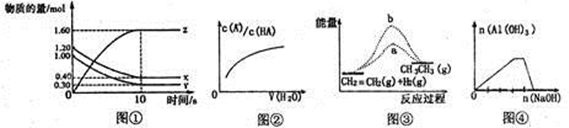
| A��ͼ�ٱ�ʾT��ʱ����2L���ܱ������У�X��Y��Z������������ʵ�����ʱ��仯�����ߡ���T��ʱ������ʼʱXΪ1.20mol��YΪ1.00mol����ƽ��ʱY��ת����Ϊ80% |
| B��ͼ�������߱�ʾ������HA��ϡ��Һ�м�ˮϡ�� |
| C��ͼ��b���߱�ʾ��ӦCH2=CH2(g)+H2(g)��CH3��CH3(g) ��H<0��ʹ�ô���ʱ����Ӧ�����е������仯 |
| D��ͼ�ܱ�ʾ��NH4Al(SO4)2��Һ�еμӹ�����NaOH��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2NO2��ƽ�⡣��ͼ�Ǹ�һ��ʱ��ⶨ����N2O4��Ũ�ȣ�������ΪN2O4��Ũ�ȣ�������Ϊʱ�䣩
2NO2��ƽ�⡣��ͼ�Ǹ�һ��ʱ��ⶨ����N2O4��Ũ�ȣ�������ΪN2O4��Ũ�ȣ�������Ϊʱ�䣩
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 p C�У�m��n��pΪ�����ʵļ��������ֲ��Cÿ��������a mol/L��Bÿ���Ӽ���1��5a mol/L��Aÿ���Ӽ���0��5a mol/L����m��n��pΪ
p C�У�m��n��pΪ�����ʵļ��������ֲ��Cÿ��������a mol/L��Bÿ���Ӽ���1��5a mol/L��Aÿ���Ӽ���0��5a mol/L����m��n��pΪ| A��2��3��1 | B��1��3��2 | C��2��3��3 | D��3��2��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2NH3(g)����H��0����Ӧ������ͼ������˵����ȷ����
2NH3(g)����H��0����Ӧ������ͼ������˵����ȷ����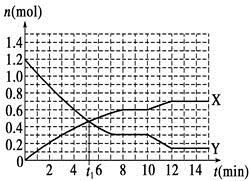
| A��t1minʱ�����淴Ӧ������� |
| B��X���߱�ʾNH3�����ʵ�����ʱ��仯�Ĺ�ϵ |
| C��0��8 min��H2��ƽ����Ӧ����v(H2)��mol��L��1��min��1 |
| D��10��12 min��N2��ƽ����Ӧ����v(N2)��0.25 mol��L��1��min��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��1��5mol/(L��min�� | B��0��15mol/(L��min) |
| C��0��75mol/(L��min�� | D��0��075mol/(L��min) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 C(g)������һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ�IJ����������������˵����ȷ����
C(g)������һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ�IJ����������������˵����ȷ����| t/s | 0 | 5 | 15 | 25 | 35 |
| n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CH3OH(g)�������ͼʾ�ش��������⣺
CH3OH(g)�������ͼʾ�ش��������⣺
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com