
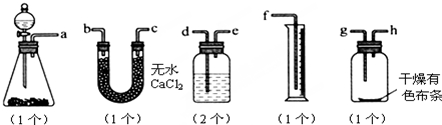
分析 (1)依据实验目的及各装置作用:制备氯气,除去氯化氢,干燥氯气,验证氯气的漂白性,排水法测气体的体积;
(2)依据图中仪器形状说出其名称,依据分液漏斗使用方法解答;
(3)浓盐酸易挥发,制取的氯气中含有氯化氢和水蒸气,氯化氢易溶于水,氯气在饱和食盐水中溶解度不大,浓硫酸具有吸水性,能够干燥氯气;
(4)量筒中未收集到液体,说明没有氯气生成或氯气被其它物质吸收或漏气;
(5)氯气不具有漂白性,具有漂白性的是次氯酸.
解答 解:(1)本实验有两个目的,其一是验证干燥的氯气没有漂白性;其二是测量氯气的体积.由于测量氯气的体积是根据排入量筒里的水来读出,所以验证干燥的氯气无漂白性的实验必须放在测量氯气的体积之前(否则无法连接),所以其连接顺序:发生装置→除氯化氢杂质→除水蒸气→验证漂白性→排液体→收集液体,除去水蒸气可以用装有无水CaCl2的U型管,也可以用盛有浓硫酸的洗气瓶,则连接顺序是:a接d、e接b或c、c或b接g、h接e、d接f,
故答案为:d;e;b或c;c或b;g;h;e;d;f;
(2)图中滴加液体的仪器为分液漏斗,使用分液漏斗正确方法:先将上口的玻璃塞打开,然后选择活塞使分液漏斗中的液体缓缓流下;
故答案为:分液漏斗;先将上口的玻璃塞打开,然后选择活塞使分液漏斗中的液体缓缓流下;
(3)浓盐酸易挥发,制取的氯气中含有氯化氢和水蒸气,氯化氢易溶于水,氯气在饱和食盐水中溶解度不大,所以选择饱和食盐水除去氯化氢;浓硫酸具有吸水性,能够干燥氯气;
故答案为:饱和食盐水;浓硫酸;
(4)量筒中未收集到液体,可能是没有氯气产生或产生的氯气被溶液吸收或是装置漏气,故答案为:没有氯气产生或产生的氯气被溶液吸收或是装置漏气;
(5)氯气不具有漂白性,氯气与水反应生成次氯酸,方程式:Cl2+H2O=HCl+HClO,次氯酸具有漂白性,干燥布条没有水,不能生成次氯酸,所以不褪色,
故答案为:氯气不具有漂白性,有漂白性的次氯酸,而干燥布条不含水,不能发生反应:Cl2+H2O=HCl+HClO,生成次氯酸,所以布条不褪色.
点评 本题考查探究氯气的性质,难点是将装置进行排序,根据实验目的来分析解答即可,难度较大.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:解答题

| 反应温度/℃ | 反应时间(min) | 收率 |
| 30~35 | 180 | 10.0 |
| 20~25 | 60 | 18.0 |
| 20~25 | 120 | 26.0 |
| 20~25 | 180 | 58.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉和纤维素的通式都是(C6H10O5)n,是同分异构体 | |
| B. | 向鸡蛋清溶液中加入(NH4)2SO4饱和溶液,有沉淀析出,再加水沉淀不溶解 | |
| C. | 油脂、糖类和蛋白质是食物含有的主要营养物质,它们都是高分子化合物 | |
| D. | 可以用新制的Cu(OH)2悬浊液检验患者的尿液中是否含糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
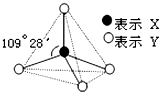 甲、乙、丙、丁、戊具有如图所示的结构或结构单元,图中四面体外可能有的部分未画出,只有实线表示共价键,X、Y可同可不同.
甲、乙、丙、丁、戊具有如图所示的结构或结构单元,图中四面体外可能有的部分未画出,只有实线表示共价键,X、Y可同可不同.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | K+ Na+ Cu2+ Al3+ |
| 阴离子 | SO42- HCO3-NO3- OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 推广使用燃煤脱硫技术,在燃煤中加入适量石灰石,可减少废气中的SO2 | |
| B. | 实施绿化工程,防治扬尘污染 | |
| C. | 研制开发燃料电池汽车,消除机动车尾气污染 | |
| D. | 加高工厂的烟囱,使烟尘和废气远离地表 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液呈电中性,胶体带有电荷 | |
| B. | 溶液中溶质微粒一定带电,胶体中分散质粒子带电,且通电后,溶质粒子向两极移动,胶体粒子向一极移动 | |
| C. | 溶液中溶质粒子有规律运动,而胶体粒子无规律运动 | |
| D. | 溶液中通过一束光线时无特殊现象,胶体中通过一束光时有明显的光带 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学兴趣小组用图一所示装置进行探究实验.以验证产物中有乙烯生成且乙烯具有不饱和性.当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色.
某化学兴趣小组用图一所示装置进行探究实验.以验证产物中有乙烯生成且乙烯具有不饱和性.当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com